Перейти к:
Возможность использования внутривенного лазерного облучения крови для коррекции процессов пероксидации и антиоксидантной активности в результате хирургического дистресса
https://doi.org/10.37895/2071-8004-2021-25-2-22-27
Аннотация
Цель исследования. Выявить протекторное влияние сеансов внутривенного низкоинтенсивного лазерного облучения крови во время оперативных вмешательств в области желчного пузыря, исследовать состояние антиоксидантной активности, перекисного окисления липидов и эндогенной интоксикации.
Материал и методы. В основной (I) группе наблюдения у 40 пациентов в периоперационном периоде применяли традиционные методы лечения, основанные на сочетанном применении фармакологических препаратов, и дополнительно – сеансы внутривенного лазерного облучения крови (ВЛОК). У 45 больных контрольной (II) группы применяли только традиционные (фармакотерапевтические) методы периоперационной подготовки. В обеих группах во время хирургического вмешательства анестезиологическую защиту осуществляли методом классической нейролептаналгезии. По возрастному составу больные в сравниваемых группах существенно не отличались. Методика внутривенного лазерного облучения крови применялась с использованием гелий-неонового лазера «Атолл» 632 нм («Фокон», Санкт-Петербург). Во время операции проводили три сеанса облучения при мощности излучения 20 мВт и длительности сеанса 15 мин на различных этапах операции: за 30 мин до вводного наркоза, на травматичном этапе операции и за 30 мин до предполагаемого завершения операции. Содержание церулоплазмина и трансферрина в плазме крови определяли методом электронного парамагнитного резонанса. Рассчитывали также величину отношения церулоплазмин/трансферрин, характеризующую уровень антиокислительной активности. Уровень эндогенной интоксикации оценивали по ранее опубликованной методике. Количественной характеристикой эндогенной интоксикации в данном методе является величина оптической плотности (Д280) и суммарная оптическая плотность компонентов, относящихся к высокомолекулярным (Ф1280) и низкомолекулярным (Ф2280) фракциям. Результаты. Сеансы ВЛОК у больных нивелируют изменения содержания церулоплазмина и трансферрина в крови. Полученные данные свидетельствуют также о протекторном влиянии внутривенного лазерного облучения крови на белковые SH-группы либо активации процесса восстановления SH-групп белков, подвергшихся окислению в результате хирургической агрессии и травмы.
Заключение. Протекторное влияние внутривенного лазерного облучения крови позволяет, в дополнение к мерам стандартной предоперационной терапии, оптимизировать фармакологическую анестезиологическую защиту во время выполнения операции при существующих традиционных схемах комбинированной общей анестезии.
Ключевые слова
Для цитирования:
Мусихин Л.В., Ширяев В.С., Шветский Ф.М., Потиевская В.И., Потиевский М.Б., Горин Д.С., Бугровская О.И., Хосровян А.М. Возможность использования внутривенного лазерного облучения крови для коррекции процессов пероксидации и антиоксидантной активности в результате хирургического дистресса. Лазерная медицина. 2021;25(2):22-27. https://doi.org/10.37895/2071-8004-2021-25-2-22-27
For citation:
Musikhin L.V., Shiryaev V.S., Shvetsky F.M., Potievskaya V.I., Potievsky M.B., Gorin D.S., Bugrovskaya O.I., Khosrovyan A.M. Potentials of intravenous laser blood irradiation to correct peroxidation and antioxidant activity as a result of surgical distress. Laser Medicine. 2021;25(2):22-27. (In Russ.) https://doi.org/10.37895/2071-8004-2021-25-2-22-27
ВВЕДЕНИЕ
Перекисное окисление липидов (ПОЛ) – это химический процесс, каскад реакций превращения липидов (поступающих с пищей или синтезированных в организме) с участием свободных радикалов – активных заряженных молекул. Так как липиды – компоненты мембран всех клеток организма, реакции перекисного окисления могут приводить к нарушению их структуры и повреждению клетки, что является одним из механизмов патогенеза ряда заболеваний [1]. В организме в роли ингибирующего фактора, то есть сдерживающего реакции ПОЛ, выступает антиоксидантная система. Таким образом, патологические реакции ПОЛ могут иметь место как при чрезмерной активности самих этих процессов, так и при недостаточности работы антиоксидантной системы. В последние годы с целью оценки глубины и выраженности патологического процесса в клинической практике активно изучаются процессы свободно радикального ПОЛ. Повышенный интерес вызван тем, что процессы ПОЛ играют не только важную роль в нормальной физиологии клетки, но и выступают как ранние ключевые звенья патогенеза многих заболеваний и острых состояний [2–6]. В связи с наличием большого количества факторов активации процессов ПОЛ в ходе оперативного вмешательства, общего обезболивания, а также в ближайшем послеоперационном периоде знания об этих процессах приобретают особую актуальность для врача — анестезиолога-реаниматолога [7][8]. Развитие идеи об участии ПОЛ в патогенезе различных заболеваний позволяет рассматривать процессы пероксидации как универсальный механизм повреждения мембранных структур клетки. Свободные радикалы постоянно присутствуют в тканях и органах в норме, поддерживая определенный уровень свободнорадикального окисления, представляющего составную часть гомеокинеза. Оптимальная скорость ПОЛ регулируется функционированием про- и антиоксидантных систем [9].
В этой связи важным является положение, что ПОЛ не случайность и не исключение, а широко распространенное универсальное явление, которое постоянно происходит в той или иной мере в любой клетке и различных мембранных структурах, хотя и с неодинаковой скоростью [1].
В органах и тканях интенсивность ПОЛ во многом определяется уровнем функционирования ряда ферментативных систем, способных как активировать окисление, так и тормозить его развитие [3][10].
Между тем длительная активация процессов ПОЛ приводит к развитию синдрома липидной пероксидации, включающего повреждение мембранных липидов, нарушение ресинтеза АТФ, накопление продуктов перекисной денатурации липидов и белков [9].
Накапливаясь в клетке, продукты ПОЛ оказывают системное повреждающее действие, деполимеризуют ДНК, разобщают фосфорилирование. Окисляя SH-группы, продукты пероксидации могут легко инактивировать тиоловые ферменты, участвующие в дыхании и гликолизе. Свободнорадикальные продукты повреждают ДНК в ядрах клеток, что проявляется понижением полимеризации и активации репаративного синтеза ДНК. В результате активации ПОЛ и накопления перекисей происходит ингибирование каталитических центров белков, что делает их недоступными для протеолитических ферментов. Митохондриальное и пероксисомальное окисление жирных кислот способно продуцировать свободные радикалы в печени, и, следовательно, процессы ПОЛ могут привести к изменениям митохондриальной ДНК в окислительном фосфорилировании, которое происходит в митохондриях, вызывая структурные аномалии и истощение аденозинтрифосфата [10]. Анестезиологическое пособие, защищая больного от операционного стресса, способно неблагоприятно воздействовать на протекание некоторых метаболических процессов, в частности на процессы ПОЛ. В настоящее время известно, что анестетики и препараты, применяющиеся при анестезии, могут ингибировать процессы ПОЛ или способствовать их активации. Действие большинства анестетиков осуществляется непосредственно через изменения физико-химических свойств биомембраны [11]. Применение внутривенного низкоинтенсивного лазерного облучения (ВЛОК) существенно улучшает результаты традиционной фармакокоррекции, оптимизируя ряд показателей во время подготовки пациентов к хирургическому вмешательству, в период хирургического вмешательства и общей анестезии [12].
Таким образом, продукты перекисного окисления липидов, накапливаясь в организме, играют важную роль в патогенезе эндотоксикоза. Однако самым важным индуктором эндотоксикоза являются продукты деградации белка, так называемые средние молекулы (СМ), имеющие молекулярную массу от 500 до 5000 дальтон (внесистемная единица, применяемая для масс молекул, 1/12 атома углерода).
Важной защитной функцией организма является антиокислительная активность (АОА) крови. АОА предотвращает неконтролируемое перекисное окисление липидных и белковых компонентов клеток и биологических жидкостей, защищая мембраны и биологически активные соединения от повреждений.
Общий пул АОА формируется из нескольких низко- и высокомолекулярных компонентов. Одними из основных среди них являются церулоплазмин (ЦП), называемый также ферроксидазой, и трансферрин (ТФ). Церулоплазмин представляет собой медьсодержащий белок плазмы крови, проявляющий активность к соединениям, выступающим инициаторами перекисного окисления – двухвалентному железу и активированным формам кислорода. Поэтому АОА плазмы крови связана с концентрацией ЦП прямой пропорциональной зависимостью. Другим компонентом АОА крови является трансферрин, представляющий собой железотранспортный белок и относящийся к так называемым «белкам острой фазы». АОА трансферрина обусловлена его способностью связывать свободное железо – мощный эндогенный прооксидант. Вместе с традиционно используемыми методами оценки перекисного окисления определение трансферрина все чаще используют для характеристики АОА.
Цель работы: выявить протекторное влияние сеансов внутривенного низкоинтенсивного лазерного облучения крови во время оперативных вмешательств в области желчного пузыря, исследовать состояние антиоксидантной активности, ПОЛ и эндогенной интоксикации.
МАТЕРИАЛ И МЕТОДЫ
Работа основана на данных обследования 85 пациентов (59 женщин, 26 мужчин), оперированных в плановом порядке на клинической базе ФГБУ «ГНЦ ЛМ ФМБА России».
В основной (I) группе наблюдения у 40 пациентов в периоперационном периоде применяли комбинированные методы лечения, основанные на сочетанном применении фармакологических препаратов и сеансов ВЛОК. У 45 больных контрольной (II) группы применяли традиционные (фармакотерапевтические) методы периоперационной подготовки без проведения сеансов ВЛОК. В обеих группах во время хирургического вмешательства (холецистэктомии) анестезиологическую защиту осуществляли методом классической нейролептаналгезии. По возрастному составу больные в сравниваемых группах существенно не отличались: средний возраст больных основной группы составил 57,32 ± 1,68 года, в контрольной группе – 56,77 ± 2,23 года. Средняя масса тела у больных основной группы составила 68,7 ± 1,32 кг, в контрольной группе – 69,5 ± 1,49 кг.
У 40 пациентов основной группы в период выполнения хирургического вмешательства анестезиологическая защита (НЛА) была дополнена сеансами ВЛОК, которое проводилось с использованием гелий-неонового лазера «Атолл» 632 нм («Фокон», Россия). Сеансы ВЛОК проводили на всех этапах периоперационного периода. Во время операции проводили 3 сеанса облучения при мощности излучения 20 мВт и длительности сеанса 15 мин на различных этапах операции:
- первый сеанс за 30 мин до вводного наркоза – для улучшения показателей вегетативного статуса, микроциркуляции, гемореологии и иммунитета;
- второй сеанс на травматичном этапе операции – для улучшения адаптационных механизмов больного, снижения реакции организма на хирургический дистресс;
- третий сеанс за 30 мин до предполагаемого завершения операции – для снижения содержания в крови продуктов ПОЛ, улучшения показателей гемореологии и микроциркуляции, оптимизации тканевого обмена.
МЕТОДЫ ИЗУЧЕНИЯ АОА, ПОЛ И СМ
Содержание церулоплазмина (ЦП) и трансферрина (ТФ) в плазме крови определяли методом электронного парамагнитного резонанса (ЭПР). Рассчитывали также величину отношения ЦП/ТФ, характеризующую уровень АОА. Уровень эндогенной интоксикации оценивали по ранее опубликованной методике [11]. Количественной характеристикой эндогенной интоксикации в данном методе является величина оптической плотности (Д280) и суммарная оптическая плотность компонентов, относящихся к высокомолекулярным (Ф1280) и низкомолекулярным (Ф2280) фракциям. Статистическую обработку всех полученных данных осуществляли в среде MS Windows 2003 с применением пакета компьютерных программ Excel.
АНЕСТЕЗИОЛОГИЧЕСКАЯ ЗАЩИТА
Накануне хирургического вмешательства для обеспечения психического покоя и комфорта всем пациентам назначали феназепам (0,5–1,0 мг) или нозепам (15–20 мг). Стандартную премедикацию (за 30–40 мин до вмешательства) всем больным осуществляли внутримышечным введением традиционных фармпрепаратов: 0,1%-ный раствор атропина – 1 мг; 2%-ный раствор промедола – 20 мг; 1%-ный раствор димедрола – 10 мг. Индукция в наркоз: в основном индукцию проводили внутривенным 5–10 мг дормикума или 100–150 мг пропофола, 100–200 мг фентанила. Расход препаратов на 1 кг массы больного не имел существенных различий в обеих группах. Для интубации трахеи использовали миорелаксанты деполяризующего механизма действия из расчета 2 мг на 1 кг массы. Для поддержания миоплегии в течение всей операции применяли ардуан путем дробного введения в дозе 1–2 мг через каждые 40–45 мин. Основной наркоз проводили газовой смесью закиси азота с кислородом в соотношении (2 : 1) – (3 : 1) в сочетании с препаратами для нейролептаналгезии. В качестве наркотического аналгетика использовали 0,005%-ный раствор фентанила в дозе 0,05 мг через 20 мин. Дроперидол применяли с учетом динамики артериального давления, травматичности и длительности оперативного вмешательства.
Отличием в проводимом лечении было использование у пациентов основной группы внутривенного лазерного облучения в качестве нефармакологической составляющей.
РЕЗУЛЬТАТЫ
Включение ВЛОК в качестве компонента консервативной терапии способствовало более раннему купированию болевого синдрома и признаков острого воспалительного процесса у пациентов основной группы от начала терапии (36,0 ± 2,5 ч.). В контрольной группе эффект консервативной терапии проявлялся через 44,0 ± 3,0 ч. Через 72 часа уровень средних молекул у больных контрольной и основной групп соответствовал значениям 0,380 ± 0,031 и 0,332 ± 0,032 соответственно.
Как показали исследования, операционный дистресс приводит к снижению содержания трансферрина, а следовательно, и к снижению антиокислительной активности крови. На рисунке 1 представлены изменения относительного содержания трансферрина в плазме крови на различных этапах хирургического вмешательства. Снижение антиокислительной активности, о которой свидетельствуют данные рисунка 1, наблюдалось у пациентов обеих групп, однако в группе с внутривенным лазерным облучением крови эти изменения были выражены в меньшей степени.
На рисунке 2 представлены результаты относительных изменений содержания ЦП в процессе операции. Представленные результаты демонстрируют, что в ходе оперативного вмешательства у пациентов контрольной группы содержание ЦП в крови увеличивалось, вероятно, в ответ на накопление эндогенных субстратов (железа, активных форм кислорода, катехоламинов и др.). К концу операции содержание ЦП, снижающееся ниже исходного уровня, видимо, является свидетельством истощения его запасов у пациентов контрольной группы.
Сеансы ВЛОК у больных, по полученным нами данным, нивелируют изменения содержания ЦП в крови. Как видно на рис. 2, на протяжении всей операции в этих условиях содержание ЦП практически не изменялось. Полученные у пациентов основной группы данные свидетельствуют, с нашей точки зрения, о подавлении в условиях лазерного облучения индуцируемого операционным дистрессом выброса эндогенных субстратов. То есть в результате стабилизирующего действия лазерного облучения, очевидно, в организме отпадает необходимость вывода дополнительных количеств ЦП из депо.
На рисунке 3 представлены результаты определения уровня средних молекул на различных этапах обследования.
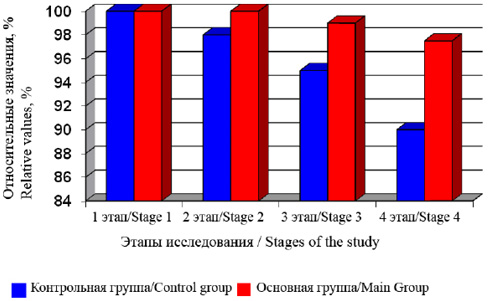
Рис. 1. Изменения относительного содержания трансферрина у пациентов обеих групп на этапах операции и общей анестезии. 1-й этап – исходные показатели, 2-й этап – начало операции, 3-й этап – травматичный этап операции, 4-й этап – конец операции и общей анестезии
Fig. 1. Changes in the relative content of transferrin in patients of both groups at surgical stages and at general anesthesia. Stage 1 – initial findings, Stage 2 – beginning of surgery; Stage 3 – traumatic stage of surgery; Stage 4 – end of surgery and general anesthesia
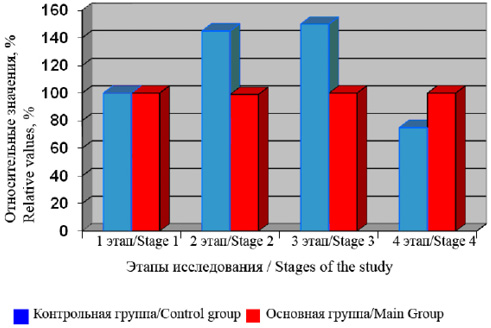
Рис. 2. Относительные изменения церулоплазмина в крови у пациентов обеих групп в процессе операции и общей анестезии. 1-й этап – исходные показатели, 2-й этап – начало операции, 3-й этап – травматичный этап операции, 4-й этап – конец операции и общей анестезии
Fig. 2. Relative changes of ceruloplasmin in blood of patients from both groups during surgery and general anesthesia. Stage 1 – initial findings, Stage 2 – beginning of surgery, Stage 3 – traumatic stage of surgery, Stage 4 – end of surgery and general anesthesia

Рис. 3. Относительные изменения уровня средних молекул у пациентов обеих групп во время операции и анестезии. 1-й этап – исходные показатели, 2-й этап – начало операции, 3-й этап – травматичный этап операции, 4-й этап – конец операции и общей анестезии
Fig. 3. Relative changes in the level of average molecules in patients of both groups during surgery and anesthesia. Stage 1 – initial findings, Stage 2 – beginning of surgery, Stage 3 – traumatic stage of surgery, Stage 4 – end of surgery and general anesthesia
Проведенные нами исследования позволили обнаружить в контрольной группе пациентов заметную отчетливую тенденцию к росту уровня эндогенной интоксикации. Так, на третьем этапе прирост концентрации средних молекул составил 8 %, а к концу операции и анестезии – 17 %. У пациентов, которым проводили сеансы ВЛОК, уровень средних молекул оставался стабильным на протяжении всей операции и только на завершающем этапе превысил исходные значения на 3 %.
Одной из «мишеней» окислительных процессов, индуцируемых хирургической агрессией, являются также и белковые SH-группы. Следует указать, что исходный уровень белковых SH-групп у пациентов в обеих группах существенно не отличался. Во время хирургического вмешательства у больных, которым не проводили протекторных сеансов ВЛОК, мы отметили снижение уровня SH-групп с 0,129 ± 0,03 (исходные данные) до 0,075 ± 0,021 (травматичный этап операции). У пациентов основной группы была отмечена отчетливая тенденция к увеличению уровня SH-групп с 0,084 ± 0,029 (исходные данные) до 0,128 ± 0,033 (травматичный этап операции).
ЗАКЛЮЧЕНИЕ
Внутривенное низкоинтенсивное лазерное облучение крови является одним из современных эффективных нефармакологических методов воздействия, позволяющих за счет поливалентного воздействия на организм осуществить адекватную коррекцию имеющихся сдвигов ряда показателей гомеостаза, стимулировать внутренние резервы и снизить фармакологическую нагрузку на пациента в периоперационных периодах.
Протекторное влияние внутривенного лазерного облучения крови позволяет, в дополнение к мерам стандартной предоперационной терапии, оптимизировать фармакологическую анестезиологическую защиту во время выполнения операции при существующих традиционных схемах комбинированной общей анестезии.
Список литературы
1. Gaschler M.M., Stockwell B.R. Lipid peroxidation in cell death. Biochem Biophys Res Commun. 2017; 482 (3): 419–425. DOI: 10.1016/j.bbrc.2016.10.086
2. Щербак В.А. Перекисное окисление липидов желчи при хронических гастродуоденитах у детей. Актуальные проблемы клинической и экспериментальной медицины. 2018: 130–132.
3. Колесникова Л.И., Рычкова Л.В., Колесников С.И. и др. Оценка системы липопероксидации и антиоксидантной защиты у мальчиков-подростков с экзогенно-конституциональным ожирением с использованием коэффициента окислительного стресса. Вопросы питания. 2018; 87 (1): 28–34. DOI: 10.24411/0042-8833-2018-10003
4. Колесникова Л.И., Даренская М.А., Рычкова Л.В. и др. Антиоксидантный статус у подростков-представителей малых сибирских этносов. Журнал эволюционной биохимии и физиологии. 2018; 54 (2): 116–121.
5. Оксенюк О.С., Калмыкова Ю.А., Смирнова О.Б. и др. Роль окислительного стресса в развитии хронической болезни почек и способы его оценки. Журнал фундаментальной медицины и биологии. 2016; (1): 15–24.
6. Разина А.О., Руненко С.Д., Ачкасов Е.Е. Проблема ожирения: современные тенденции в России и в мире. Вестник Российской академии медицинских наук. 2016; 71 (2): 154–159. DOI: 10.15690/vramn655
7. Сумин С.А., Авдеева Н.Н., Быстрова Н.А. и др. Структурно-функциональные свойства эритроцитов при использовании различных методов многокомпонентной общей анестезии при лапароскопической холецистэктомии у больных желчнокаменной болезнью. Анестезиология и реаниматология. 2016; 4 (61): 296–300. DOI: 10.18821/0201-7563-2016-61-4-296-300
8. Малышев В.Д., Потапов А.Ф. Нарушение процессов перекисного окисления липидов у хирургических больных на этапах лечения. Анестезиология и реаниматология. 1994; (6): 53–59.
9. Журавлев А.И., Зубкова С.М. Антиоксиданты. Свободно-радикальная патология. М.: МГАВМиБ – МВА имени К.И. Скрябина; 2008: 269 с.
10. Fucho R., Casals N., Serra D., Herrero L. Ceramides and mitochondrial fatty acid oxidation in obesity. FASEB J. 2017; 31 (4): 1263–1272. DOI: 10.1096/fj.201601156R
11. Рябов Г.А., Азизов Ю.М., Пасечник И.Н., Крылов В.В., Цветков Д.С. Окислительный стресс и эндогенная интоксикация у больных в критическом состоянии. Вестник интенсивной терапии. 2002; (4): 4–7.
12. Смольников П.В., Ширяев В.С., Мусихин Л.В. и др. Низко интенсивная лазерная терапия в гериатрической практике анестезиологии-реаниматологии. Лазерная медицина. 2015; 19 (4): 11–18. DOI: 10.37895/2071-8004-2015-19-4-11-18
Об авторах
Л. В. МусихинРоссия
Мусихин Леонид Венедиктович – кандидат медицинских наук, ведущий научный сотрудник отделения анестезиологии и реаниматологии
г. Москва
В. С. Ширяев
Россия
Ширяев Владимир Сергеевич – кандидат медицинских наук, руководитель отделения анестезиологии и реаниматологии
г. Москва
Ф. М. Шветский
Россия
Шветский Филипп Михайлович – кандидат медицинских наук, старший научный сотрудник отделения анестезиологии и реаниматологии
г. Москва
В. И. Потиевская
Россия
Потиевская Вера Исааковна – доктор медицинских наук, главный научный сотрудник, заведующая кардиологическим отделением Московского научного исследовательского онкологического института им. П.А. Герцена – филиала
г. Москва
М. Б. Потиевский
Россия
Потиевский Михаил Борисович – ординатор
г. Москва
Д. С. Горин
Россия
Горин Дмитрий Семенович – врач
г. Москва
О. И. Бугровская
Россия
Бугровская Ольга Ивановна – заведующая отделением реанимации
г. Москва
А. М. Хосровян
Россия
Хосровян Ашхен Мавровна – кандидат медицинских наук, врач
г. Москва
Рецензия
Для цитирования:
Мусихин Л.В., Ширяев В.С., Шветский Ф.М., Потиевская В.И., Потиевский М.Б., Горин Д.С., Бугровская О.И., Хосровян А.М. Возможность использования внутривенного лазерного облучения крови для коррекции процессов пероксидации и антиоксидантной активности в результате хирургического дистресса. Лазерная медицина. 2021;25(2):22-27. https://doi.org/10.37895/2071-8004-2021-25-2-22-27
For citation:
Musikhin L.V., Shiryaev V.S., Shvetsky F.M., Potievskaya V.I., Potievsky M.B., Gorin D.S., Bugrovskaya O.I., Khosrovyan A.M. Potentials of intravenous laser blood irradiation to correct peroxidation and antioxidant activity as a result of surgical distress. Laser Medicine. 2021;25(2):22-27. (In Russ.) https://doi.org/10.37895/2071-8004-2021-25-2-22-27
JATS XML


























