Перейти к:
Применение лазеротерапии в комплексном лечении больных с компрессионно-ишемической невропатией
https://doi.org/10.37895/2071-8004-2021-25-1-36-44
Аннотация
Цель исследования. Разработка способа лечения повреждений нервов, обеспечивающего снижение травматичности, опасности побочных реакций и повышение эффективности лечения компрессионно-ишемической невропатии.
Материалы и методы. В исследование включены 22 пациента с компрессионно-ишемической невропатией. Для проведения лазеротерапии использовали лазерный аппарат низкоинтенсивного лазерного излучения «АЛОК-1», позволяющий воздействовать непосредственно на ткани лазерным лучом диаметром 0,8 мм и мощностью 1 мВт (длина волны излучения – 0,63 мкм).
Результаты. Разработанным способом лазеротерапии удалось достичь субъективного, объективного и, по данным инструментального обследования, существенного улучшения по сравнению с дооперационным периодом.
Заключение. Интраоперационная лазеротерапия компрессионно-ишемической невропатии показала достаточную эффективность, о чем свидетельствуют значительное уменьшение выраженности симптомов, вплоть до полного их регресса, а также высокий уровень удовлетворенности пациентов результатами операции.
Для цитирования:
Шпагин М.В., Яриков А.В., Павлов С.С., Соколов А.А. Применение лазеротерапии в комплексном лечении больных с компрессионно-ишемической невропатией. Лазерная медицина. 2021;25(1):36-44. https://doi.org/10.37895/2071-8004-2021-25-1-36-44
For citation:
Shpagin M.V., Yarikov A.V., Pavlov S.S., Sokolov A.A. Laser therapy in the complex treatment of patients with compression-ischemic neuropathy. Laser Medicine. 2021;25(1):36-44. (In Russ.) https://doi.org/10.37895/2071-8004-2021-25-1-36-44
ВВЕДЕНИЕ
Среди заболеваний периферической нервной системы компрессионно-ишемические невропатии (КИН) составляют от 25 до 45 % [1]. На долю верхней конечности приходится 80 % случаев всех туннельных невропатий, что связано с большой профессиональной и бытовой нагрузкой на верхние конечности и плечевой пояс [2][3]. Туннельные синдромы – это группа заболеваний, клинические проявления которых обусловлены компрессией нервного ствола в анатомическом туннеле, что приводит в свою очередь к раздражению и нарушению проводимости заинтересованного нерва [4][5]. КИН часто приводит к ограничению повседневной активности, ухудшению сна, лекарственной зависимости, снижению качества жизни, депрессии, а иногда – к потере трудоспособности [6][7].
КИН является полиэтиологическим заболеванием, которое возникает под воздействием различных факторов [8][9]. Острые и хронические травмы верхних конечностей, заболевания и состояния, сопровождающиеся отеками верхних конечностей (почечная недостаточность, беременность и ожирение), изменениями в суставах, костной ткани, мышцах и сухожилиях (ревматоидный артрит, ревматизм, подагра, ожирение, гипотиреоз, системная склеродермия) и опухоли мягких тканей, вызывающие компрессию нервов, являются факторами риска КИН [3][10].
Нервы чаще могут быть сдавлены при прохождении через анатомические туннели (карпальный, кубитальный или фибулярный каналы и др.) [11]. Так, КИН лучевого нерва развивается при сдавлении на уровне подмышечной впадины («костыльный неврит»), средней трети плеча в области спирального канала («паралич субботней ночи», «синдром парковой скамейки»), нижней трети предплечья («синдром Вартенберга», «синдром наручных часов»). КИН срединного нерва – при сдавлении на уровне верхней трети предплечья («синдром Сейфарта», «синдром круглого пронатора»).
При КИН возникают следующие патофизиологические изменения [6]:
1) нарушение венозного оттока в нерве;
2) истончение миелиновой оболочки;
3) ишемия нерва.
Несмотря на то, что КИН довольно распространены, охарактеризовать изменения, которые происходят в сдавленном нерве, трудно, потому что неэтично изучать нервную ткань у живого человека. При патологоанатомическом исследовании субклинического ущемления срединного и локтевого нервов было отмечено утолщение эндоневрия, периневрия и эпиневрия [12]. Смоделированные туннельные невропатии у экспериментальных животных показали, что когда нервные волокна подвергаются сжатию, патологическая реакция зависит от силы, приложенной к месту, и продолжительности воздействия. Острая кратковременная компрессия приводит к локальной блокаде проводимости в результате локальной ишемии, которая обратима, если компрессия носит временный характер. При длительном очаговом сжатии появляются ишемические изменения, за которыми следует отек эндоневрия и вторичное утолщение периневрия. Эти гистологические изменения усугубят изменения микроневрального кровообращения и увеличат чувствительность оболочки нейрона к ишемии. Если компрессия продолжается, развивается очаговая демиелинизация, которая обычно приводит к большему вовлечению двигательных, чем сенсорных нервных волокон. Даже на этом этапе клинические и электрофизиологические признаки могут исчезнуть в течение нескольких недель или месяцев.
Когда длительность компрессии превышает несколько часов, развивается диффузная демиелинизация, приводящая к повреждению самих аксонов. Этот процесс начинается на дистальном конце компрессии или травмы, и этот процесс называется валлеровской дегенерацией. Эти нервные изменения могут проявляться неоднородно по всей нервной оболочке в зависимости от распределения сжимающих сил, вызывая смешанное демиелинизирующее и аксональное повреждение в результате комбинации механического искажения нерва, ишемического повреждения и нарушения аксонального потока [13].
Вторично по отношению к валлеровской дегенерации, шванновские клетки подвергаются запрограммированной дедифференцировке, включая подавление белков миелина и клеточную пролиферацию, что в итоге приводит к демиелинизации [14][15].
КИН представлены следующими группами клинических симптомов [7][16][17]:
1) чувствительные расстройства в виде онемения и парестезий в зоне иннервации нерва;
2) двигательные расстройства;
3) атрофия мышц;
4) вегетативные нарушения в виде отека мягких тканей, трофических изменений кожи, ногтей, изменения цвета кожи.
В комплекс консервативного лечения КИН входит НПВП, глюкортикостероиды, антиоксидантные, антихолинэстеразные препараты, лекарственные средства, улучшающих микроциркуляцию, витамины группы В, ношение жестких ортезов и кинезиотейпирование [18][19][20]. Помимо медикаментозного лечения применяются методы физиотерапии – лазерная терапия, магнитотерапия, ультразвуковая терапия, дарсонвализация, электрофорез лекарственных препаратов, импульсные токи, массаж и рефлексотерапия; которые имеют низкий уровень доказательности в лечении КИН [21][22]. Консервативное лечение КИН может быть эффективно лишь в случаях легких электрофизиологических нарушений, при умеренных или тяжелых нарушениях необходимо нейрохирургическое вмешательство [19][23].
Хирургическая декомпрессия нервов при туннельных синдромах применяется пациентам, прошедшим курс консервативного лечения без эффекта, у которых имеются положительные провокационные тесты (Тинеля, Фалена и др.) и симптомы заболевания [22][24]. Хирургическая декомпрессия может быть применена в посттравматических ситуациях с целью невролиза, удаления рубцовой ткани и достижения декомпрессии.
Наиболее часто для хирургического лечения КИН применяется простая декомпрессия из открытого доступа, в ходе которой проводят невролиз (высвобождают нерв от рубцовых сращений с окружающими тканями) [25][26][27][28][29]. Преимущества простой декомпрессии – несложная техника выполнения операции, возможность тщательно осмотреть операционное поле, малая деваскуляризация нерва во время операции, малый послеоперационный рубец. В соответствии с данными крупного контролируемого исследования 70 % пациентов с КИН, перенесших простую декомпрессию, достигают значимого клинического улучшения [30][31]. Декомпрессия с транспозицией по сравнению с простой декомпрессией одинаково эффективна в лечении КИН как по клиническим, так и по нейрофизиологическим показателям. Но при декомпрессии с транспозицией отмечено большее число послеоперационных осложнений – раневых инфекций (как поверхностных, так и глубоких), чем при простой декомпрессии [32].
Известен способ лечения повреждений нервов путем прямой электростимуляции [33]. При этом во время операции на поврежденный участок нерва устанавливают и фиксируют клеем и кетгутом через эпиневрий два электрода, которые выводят через дополнительные проколы рядом с операционной раной. Со вторых суток после операции проводят электростимуляцию по 30 минут 4 раза в день в течение 3–5 недель. Недостатком способа является травматичность за счет оставления в операционной ране инородных тел (электродов) на длительный срок, что может вызвать стойкие болезненные ощущения, отек, нагноение.
Существуют способы лечения повреждений периферических нервов путем подведения световода через иглу к нерву и облучения его низкоинтенсивным лазерным излучением. Интраоперационные клинические исследования показали, что прямое лазерное облучение улучшает функциональную активность хирургически обработанного нерва. В пилотном двойном слепом рандомизированном исследовании Rochkind et al. показали, что у пациентов с неполным долгосрочным повреждением периферических нервов лазерное облучение прогрессивно улучшает функцию периферических нервов, что приводит к значительному функциональному восстановлению [34][35]. Исследования на животных и клинические исследования продемонстрировали стимулирующее действие лазеротерапии на регенерацию периферических нервов [36][37]. Однако чрескожное введение иглы и световода (инородных тел) оказывает повреждающее действие на нерв и прилегающие ткани, в т. ч. сосуды. Следствием являются боль, микрокровоизлияния и макрокровоизлияния вплоть до гематом, отек, нагноение.
Известны способы воздействия низкоэнергетическим сканирующим красным и инфракрасным лазерным излучением на поврежденный нерв и прилегающие ткани дистанционно [38][39]. Минусами данной методики лазеротерапии являются недостаточная эффективность, т. к. происходит снижение плотности потока энергии облучения при прохождении лазерного луча через ткани; непостоянный режим воздействия (характеристика гелий-неонового лазера) – не физиологичный и не стимулирующий для нерва и нервно-рецепторного аппарата; отсутствие визуального контроля облучения.
При всех достигнутых успехах, вопросы улучшения своевременной диагностики и выбора метода лечения или разработка новых методик у пациентов с КИН остаются неразрешенными. Это можно объяснить как низкой настороженностью врачей поликлинического звена, так и слабыми знаниями вопросов клиники, диагностики и лечения данной патологии практикующими нейрохирургами, а также отсутствием четких показаний к проведению той или иной методики хирургического лечения [40][41][42].
Цель исследования: разработка способа лечения повреждений нервов, обеспечивающего снижение травматичности и опасности побочных реакций, а также повышающего эффективность лечения компрессионно-ишемической невропатии.
МАТЕРИАЛЫ И МЕТОДЫ
Клинические исследования проводились на базе Нижегородского межрегионального нейрохирургического центра им. проф. А.П. Фраермана, ФБУЗ «Приволжский окружной медицинский центр» ФМБА России (г. Нижний Новгород), а также клинической базе кафедры неврологии, нейрохирургии и медицинской генетики ПИМУ.
Разработан способ лечения КИН, обеспечивающий снижение травматичности, и опасности побочных реакций, и повышающий эффективность лечения (патент RU 2494777 C2).
Целью изобретения являлось восстановление функции пораженного нерва путем усиления регенерации нерва, улучшения местного кровообращения, снятия отека в месте компрессии нерва и, в итоге, сокращение сроков лечения.
Сущность изобретения заключается в следующем: интраоперационно, после освобождения нерва из рубцовой ткани, под эпиневрий устанавливали световод аппарата низкоинтенсивного лазерного излучения «АЛОК-1». Диаметр части световода, предназначенного для введения под эпиневрий, – 0,8 мм. В течение 20 минут проводилось воздействие низкоинтенсивным лазерным излучением с длиной волны 0,63 мкм и мощностью 1,0 мВт (рис. 1, 2). Не извлекая световод из-под эпиневрия, другой его конец выводился наружу. Рана ушивалась. Через установленный таким образом световод после операции проводится курс лечения – 10 ежедневных процедур низкоинтенсивного лазерного облучения аппаратом «АЛОК-1» в течение 10 минут каждая.
В исследование включены 22 пациента (15 мужчин и 7 женщин) с КИН локтевого нерва на уровне кубитального канала, в возрасте от 38 до 58 лет (средний возраст – 48,6 ± 10,8 года). У всех пациентов причиной КИН являлась травма с анамнезом 12,2 ± 2,8 месяца. Проводился сбор жалоб, анамнеза, оценка неврологического статуса, анкетирование, электронейромиографическое исследование и, по показаниям, нейровизуализация (МРТ, КТ или УЗИ нервов). Оценка состояния проводилась при поступлении пациентов в нейрохирургическое отделение, спустя сутки после операции, на 7-й день после операции и в день выписки (табл. 1).
Таблица 1
Результаты интраоперационной лазеротерапии КИН локтевого нерва
Table 1
Outcomes after intraoperative laser therapy in ulnar nerve CIN
Показатель Parameter | До операции Before surgery | На момент выписки At discharge | Через 12 мес. In 12 months |
ВАШ VAS | 5,51 ± 3,73 | 1,15 ± 1,8 | 0,22 ± 0,96 |
SSS | 2,74 ± 0,36 | 1,66 ± 0,44 | 1,16 ± 0,24 |
FSS | 2,74 ± 0,76 | 2,22 ± 0,64 | 1,26 ± 0,68 |
Для оценки результатов хирургического лечения были использованы шкалы тяжести симптомов (Symptom Severity Scale, SSS) и шкалы функциональных нарушений кисти (Functional Severity Scale, FSS) [43][44].
Динамику интенсивности болевого синдрома измеряли по визуальной аналоговой шкале (ВАШ).
Удовлетворенность пациентов хирургическим лечением оценивали по шкале от 1 до 5 баллов: 1 балл – «полностью удовлетворен», 2 балла – «удовлетворен», 3 балла – «затрудняюсь ответить», 4 балла – «не удовлетворен», 5 баллов – «крайне не удовлетворен» [45].
Статистическую обработку данных проводили с использованием программы Statistica версии 6.0. Для анализа полученных данных применяли методы описательной статистики (минимальное и максимальное значения, среднее, стандартное отклонение). Данные представлены в виде M ± m, где M – среднее арифметическое, а m – статистическая погрешность.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При проведении клинического обследования выраженные нарушения чувствительности (от 3 до 5 баллов) выявлены у 13 пациентов (59 %, n = 22), умеренные нарушения чувствительности (от 1 до 3 баллов) – у 9 пациентов (41 %, n = 22). Для пациентов с нейропатиями локтевого нерва на уровне кубитального канала характерен длительный период восстановления функции нерва. Оценка результатов лечения, связанных с восстановлением чувствительности, проведена через 12 месяцев после операции у 17 пациентов (77,2 %, n = 22): у 13 пациентов (76,5 %, n = 17) отмечено хорошее восстановление чувствительности, у 4 пациентов (23,5 %, n = 17) – умеренное. По данным литературы, при декомпрессии с транспозицией отмечалось хорошее восстановление чувствительности от 64 до 75 % прооперированных [23][31][46][47].
В среднем по шкале ВАШ болевой синдром до операции составлял 5,51 ± 3,73 балла. В послеоперационном периоде отмечалось снижение болевого синдрома до 1,15 ± 1,8 балла. В отдаленном послеоперационном периоде (12 месяцев) у 9 пациентов (52,9 %, n = 17) болевой синдром отсутствовал. Оценка эффективности при декомпрессии с транспозицией показала, что в отдаленном послеоперационном периоде (более 12 месяцев) болевой синдром отсутствовал от 48,4 до 52 % пациентов [23][31][46][47].
Атрофия мышц встречалась у 16 пациентов (72,7 %, n = 22), когтеобразная деформация кисти – у 7 пациентов (31,8 %, n = 22). У всех пациентов отмечался положительный симптом Фромана: у 15 пациентов (68 %, n = 22) – умеренно выраженный, у 7 пациентов (32 %, n = 22) – выраженный. После проведенной операции у 19 пациентов (86 %, n = 22) симптом Фромана не проявлялся, у 4 пациентов (14 %, n = 22) сохранялось умеренное проявление симптома ( по данным литературы, при декомпрессии с транспозицией – 87 и 13 % соответственно,).
При ЭНМГ-исследовании у всех пациентов выявлено локальное замедление скорости проведения импульса (СПИ) в области локтевого сгиба. Через 12 месяцев после операции 17 пациентам была проведена ЭНМГ. Во всех случаях отмечалась положительная динамика электрофизиологических показателей: увеличение амплитуды M- и S-ответов, уменьшение резидуальной латентности, увеличение скорости проведения по моторным и сенсорным волокнам.
Оценка результатов хирургического лечения по шкалам SSS (11 вопросов, касающихся выраженности, интенсивности и продолжительности болевых, чувствительных нарушений) и FSS (8 вопросов, позволяющих получить представление о ежедневных видах бытовой физической активности пациента) показали положительную динамику: средние показатели по SSS уменьшились с 2,74 до 1,66 балла, по FSS – с 2,74 до 2,22 балла. Через 12 месяцев после операции средние показатели по SSS уменьшились до 1,16 балла, по FSS – до 1,26 балла. Средний балл ≥ 2 считается неудовлетворительным результатом. Полученные данные согласуются с результатами других авторов [23][31].
Зафиксирована высокая удовлетворенность пациентов результатами лечения: полностью удовлетворены исходами лечения 77,3 % пациентов, удовлетворены – 9,1 %, не удовлетворены – 13,6 %.
При сравнении количества койко-дней, приведенных в стационаре, пациентов после интраоперационной лазеротерапии с данными литературы о результатах хирургического лечения другими методами существенного различия не найдено.
КЛИНИЧЕСКИЙ ПРИМЕР
Пациент Д., 1948 г.р., поступил в нейрохирургическое отделение с жалобами на боль в правой кисти, слабость и ограничение движений в IV–V пальцах правой кисти, снижение чувствительности в правой кисти. Со слов больного 6 месяцев назад получил травму в области правого локтевого сустава, после чего наросла слабость и нарушение чувствительности в правой кисти. Объективно: болезненный рубец в нижней трети правого плеча, глубокое нарушение проводимости по локтевому нерву: парез мышц кисти – 1 балл, гипестезия в зоне иннервации локтевого нерва – 2 балла. Выполнена операция: невролиз локтевого нерва, установка эпиневрально световода аппарата лазеротерапии. В положении больного лежа на спине в нижней трети правого плеча выполнен разрез 10 см в проекции локтевого нерва. Острым и тупым путем на протяжении разреза выделен локтевой нерв. Нерв белого цвета, без сосудистого рисунка. Подэпиневрально введен световод аппарата низкоинтенсивного лазерного излучения (рис. 1–3).
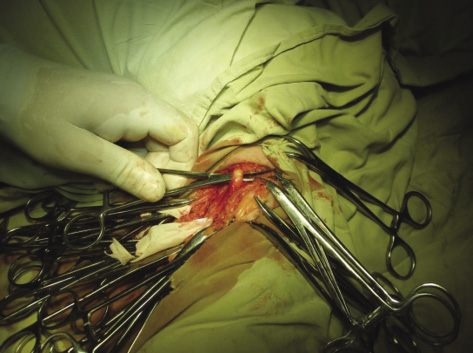
Рис. 1. Выделение поврежденного нерва из рубцов
Fig. 1. Isolation of the damaged nerve from scars
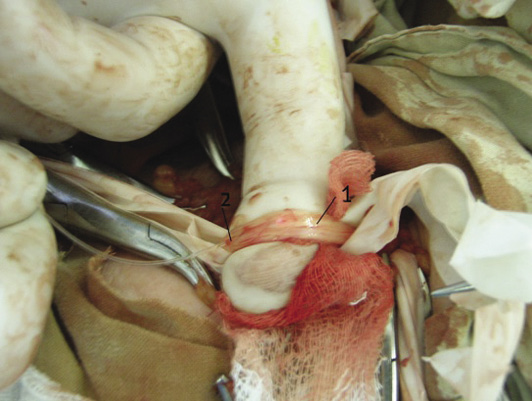
Рис. 2. Установленный по эпиневрий поврежденного нерва (1) световод (2) аппарата низкоинтенсивного лазерного излучения
Fig. 2. Light guide (2) of low-level laser device adjusted along the epineurium of the damaged nerve (1)
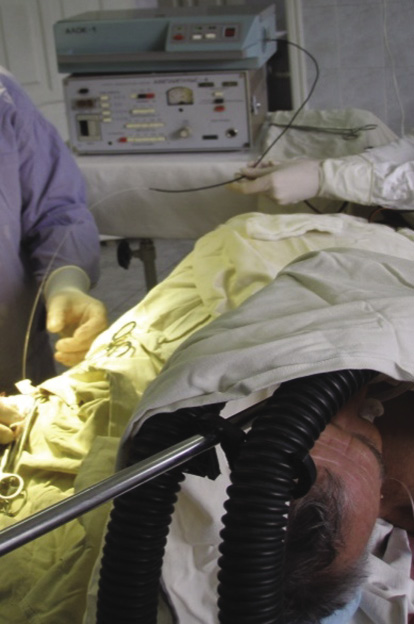
Рис. 3. Проведение интраоперационной лазеротерапии
Fig. 3. Intraoperative laser therapy
В течение 20 минут проводилось воздействие низкоинтенсивным лазерным излучением с длиной волны 0,63 мкм и мощностью 1,0 мВт. Гемостаз, контроль на отсутствие инородных тел. Не вынимая из-под эпиневрия световод, другой его конец выведен из операционной раны наружу. Внутрикожный шов. Спирт. Асептическая повязка на рану. В послеоперационном периоде через выведенный конец световода выполнялась лазеротерапия (10 процедур по 10 минут). На фоне лазеротерапии отмечена положительная динамика в виде нарастания силы в IV–V пальцах правой кисти.
Эпиневрий представляет достаточно толстую и плотную соединительно-тканную оболочку, защищающую нервные волокна от какого-либо внешнего воздействия. И в случае дистанционного воздействия эпиневрий будет поглощать большую часть лазерного излучения. Поэтому мы видим смысл ввести световод под эпиневрий для непосредственного воздействия на поврежденные нервы без потери энергии излучения.
Как показало проведенное исследование, с использованием лазеротерапии удалось достичь субъективного, объективного и, по данным инструментального обследования, существенного улучшения по сравнению с дооперационным периодом. При сравнении разработанного способа лазеротерапии КИН с другими методами результаты лечения сопоставимы. Показатели восстановления чувствительности при применении лазеротерапии были несколько лучше.
Снижение травматичности и опасности побочных реакций достигнуто за счет непосредственного воздействия световода малого диаметра только на поврежденные нервные волокна. Повышение эффективности лечения обеспечивается:
- воздействием низкоэнергетического красного лазерного излучения непосредственно на поврежденную нервную ткань, так как облучение стимулирует регенеративные процессы и улучшает обмен веществ в ишемизированных тканях;
- возможностью постоянного воздействия на поврежденную нервную ткань.
ЗАКЛЮЧЕНИЕ
Таким образом, интраоперационная лазеротерапия КИН обладает достаточной эффективностью, о чем свидетельствуют значительное уменьшение выраженности симптомов, вплоть до полного их регресса, а также высокий уровень удовлетворенности пациентов результатами операции. Необходимо проведение более широкомасштабных исследований для оценки эффективности нового способа в лечении КИН и уточнения показаний к нему.
Список литературы
1. Федяков А.Г., Дубровина О.Н., Древаль О.Н. и др. Применение интраоперационного электрофизиологического мониторинга при декомпрессии локтевого нерва в области локтевого сустава. Вопросы нейрохирургии им. Н.Н. Бурденко. 2014; 78 (6): 43–49.
2. Новиков А.В., Щедрина М.А., Мотякина О.П. Современные представления об этиологии и механизмах патогенеза компрессионно-ишемических невропатий верхней конечности (обзор литературы). Вопросы травматологии и ортопедии. 2012; 3 (4): 35–39.
3. Мухина О.В., Кузнецов А.В., Древаль О.Н. Синдром кубитального канала: диагностика и выбор тактики лечения. Современная наука: актуальные проблемы теории и практики. Серия: Естественные и технические науки. 2020; (8): 187–193.
4. Орлов А.Ю., Комков Д.Ю., Джигания Р. и др. К вопросу о состоянии кровотока по микрососудистому руслу периферических нервов конечностей при туннельных невропатиях. Российский нейрохирургический журнал им. про- фессора А.Л. Поленова. 2018; 10 (3–4): 55–60.
5. Юсупова Д.Г., Супонева Н.А., Зимин А.А. и др. Валидация Бостонского опросника по оценке карпального туннельного синдрома (Boston Carpal Tunnel Questionnaire) в России. Нервно-мышечные болезни. 2018; 8 (1): 38–45.
6. Головачева В.А., Парфенов В.А., Головачева А.А. и др. Синдром кубитального канала: современные принципы диагностики и лечения. Неврология, нейропсихиатрия, психосоматика. 2019; 11 (S1): 89–97.
7. Вершинин А.В., Гуща А.О., Арестов С.О. и др. Метод хирургического лечения карпального туннельного синдрома с применением эндоскопического контроля и электрофизиологического мониторинга. Анналы клинической и экспериментальной неврологии. 2017; 11 (3): 41–46.
8. Шток А.В., Коновалов Н.А., Оноприенко Р.А. и др. Результаты хирургического лечения пациентов с синдромом карпального канала методом декомпрессии с примене- нием эндоскопической ассистенции. Российский нейрохирургический журнал им. профессора А.Л. Поленова. 2017; 9 (4): 54–63.
9. Башлачев М.Г., Евзиков Г.Ю., Парфенов В.А. и др. Динамическая невропатия общего малоберцового нерва на уровне головки малоберцовой кости (клиническое наблюдение и обзор литературы). Нейрохирургия. 2019; 21 (1): 54–59.
10. Mendoza J.L., Salgado A.A. Compression neuropathies. Ed. N. Souayah. 2013; P. 103.
11. Белова Н.В., Юсупова Д.Г., Лагода Д.Ю. и др. Современные представления о диагностике и лечении карпального туннельного синдрома. РМЖ. 2015; 23 (24): 1429–1432.
12. Pham K., Gupta R. Understanding the mechanisms of entrapment neuropathies. Neurosurgical focus. 2009; 26 (2): E7.
13. Mackinnon S.E. Pathophysiology of nerve compression. Hand clinics. 2002; 18 (2): 231–241.
14. Tomita K., Kubo T., Matsuda K. et al. Myelin-associated glycoprotein reduces axonal branching and enhances functional recovery after sciatic nerve transection in rats. Glia. 2007; 1498–1507.
15. Thatte M.R., Mansukhani K.A. Compressive neuropathy in the upper limb. Indian J Plast Surg. 2011; 44 (2): 283.
16. Байтингер А.В., Черданцев Д.В. Синдром карпального канала: современное состояние вопроса. Вопросы реконструктивной и пластической хирургии. 2018; 65 (2): 12–18.
17. Байтингер А.В. Опыт применения эндоскопической декомпрессии срединного нерва в карпальном канале. Современные технологии лечения пациентов с травмой опорно-двигательного аппарата и центральной нервной системы: сб. ст. научн.-практ. конф. 2019: 34–38.
18. Гильвег А.С., Парфенов В.А., Евзиков Г.Ю. Вопросы диагностики и лечения синдрома запястного канала. Неврология, нейропсихиатрия, психосоматика. 2019; 11 (S1): 46–51.
19. Яриков А.В., Туткин А.В., Бояршинов А.А. и др. Карпальный туннельный синдром: клиника, диагностика и современные подходы к лечению (краткий обзор). Медицинский альманах. 2020; 3 (64): 27–35.
20. Юсупова Д.Г., Зимин А.А., Гришина Д.А. и др. Карпальный туннельный синдром: оценка необходимости реабилитационно-восстановительного лечения после эндоскопической декомпрессии срединного нерва в позднем и отдаленном послеоперационных периодах. Нервно-мышечные болезни. 2019; 9 (4): 34–43.
21. Нысанбаева Г.А. Особенности комплексного лечения больных с невропатиями верхних конечностей. Вестник КазНМУ. 2014; (1): 232–233.
22. Гильвег А.С., Парфенов В.А., Евзиков Г.Ю. Проблемы диагностики и лечения компрессионной нейропатии срединного нерва: анализ типичной врачебной практики. Журнал неврологии и психиатрии им. C.C. Корсакова. 2018; 118 (11): 30–34.
23. Мухина О.В., Кузнецов А.В., Древаль О.Н. Хирургическое лечение синдрома кубитального канала (литературный обзор). Российский нейрохирургический журнал им. профессора А.Л. Поленова. 2018; 10 (3–4): 98–108.
24. Dang A.C., Rodner C.M. Unusual compression neuropathies of the forearm. Part I: Radial Nerve. J Hand Surg. 2009; 34A: 1906–1914.
25. Dong Q., Jacobson J.A., Jamadar D.A., et al. Entrapment neuropathies in the upper and lower limbs: Anatomy and MRI features. Radiol Res Pract. 2012; 2012: 230673. DOI: 10.1155/2012/230679
26. Bismak О. Effectiveness of the program for restoring the function of the upper limb in traumatic and compression-ischemic injuries of the peripheral nerves and brachial plexus. Slobozhanskyi Herald of Science and Sport. 2020; 8 (1): 17–22.
27. Лейдерман Н.Е., Щекина Р.В., Зайончковская И.М. Опыт лечения компрессионно-ишемических невропатий в амбулаторных условиях. Медицинский вестник МВД. 2015; 6 (79): 35–38.
28. Меркулова Д.М., Меркулов Ю.А., Никитин С.С. Туннельные невропатии. Диагностика и принципы патогенетической терапии. Consilium medicum (неврология, ревматология). 2012; 2 (14): 32–38.
29. Harder K., Lukschu S., Dunda S.E., et al. Results after simple decompression of the ulnar nerve in cubital tunnel syndrome. GMS Interdisciplinary Plastic and Reconstructive Surgery DGPW. 2015; 4. DOI: 10.3205/iprs000078
30. Wojewnik B., Bindra R. Cubital tunnel syndrome – Review of current literature on causes, diagnosis and treatment. J Hand Microsurg. 2009; 1 (2): 76–81.
31. Bartels R.H., Verhagen W.I., van der Wilt G.J. et al. Prospective randomized controlled study comparing simple decompression versus anterior subcutaneous transposition for idiopathic neuropathy of the ulnar nerve at the elbow: Part 1. Neurosurgery. 2005; 56 (3): 522–530. DOI: 10.1227/01.neu.0000154131.01167.03
32. Caliandro P., La Torre G., Padua R., et al. Treatment for ulnar neuropathy at the elbow. Cochrane Database Syst Rev. 2016; 11 (11): CD006839. DOI: 10.1002/14651858.CD006839.pub4.
33. Бочкарев П.Н., Горшков Р.П., Меламуд Э.Е. и др. Многолетний опыт прямой электростимуляции нервных стволов в лечении компрессионных и тракционных повреждений периферических нервов. Современные аспекты электронейростимуляции и новые технологии в нейрохирургии и неврологии. 1998: 61–63.
34. Rochkind S. Review of 30-years experience: Laser phototherapy in neuroscience and neurosurgery. Part I – muscle and nerve. Laser Therapy. 2009; 18 (1): 27–38.
35. Rochkind S. Review of 30-years experience: Laser phototherapy in neuroscience and neurosurgery. Part II – nerve cells, brain and spinal cord. Laser Therapy. 2009; 18 (3): 127–136.
36. Bae C.S., Lim S.C., Kim K.Y., et al. Effect of Ga-As laser on the regeneration of injured sciatic nerves in the rat. In Vivo. 2004; 18 (4): 489–495.
37. Bagis S., Comelekoglu U., Coskun B. Effect of GaAs (904 nm) laser irradiation on the intact skin of the injured rat sciatic nerve. Lasers Med Sci. 2003; 18 (2): 83–88.
38. Способ лечения повреждений нервов: Пат. № 2185214 Рос. Федерация; МПК A61N 5/067 (2000.01) / Берснев В.П., Тышкевич Т.Г., Яковенко И.В., Шукри А., Яштыков Б.А.; заявитель и патентообладатель Российский научно-исследовательский нейрохирургический институт им. проф. А.Л. Поленова. – № 99123455/14; заявл. 05.11.1999, опубл. 20.07.2002. – Бюл. № 20.
39. Рокхинд С. Инновационный подход к лазерной фототерапии для лечения повреждения периферических нервов и сохранности денервированной мышцы. Лазерная медицина. 2014; 18 (4): 69–70.
40. Еськин Н.А., Голубев В.Г., Приписнова С.Г. Современные возможности диагностики и лечения туннельных синдромов верхней конечности. Актуальные вопросы ортопедии и травматологии. Киев: АМН Украины; 2004: 464–469.
41. Джигания Р., Орлов А.Ю., Короткевич М.М. и др. Анализ неудовлетворенных результатов хирургического лечения пациентов с синдромом кубитального канала. Материалы Всероссийской научно-практической студенческой конференции с международным участием. СПб.; 2018: 160.
42. Байтингер А.В., Черданцев Д.В., Рыбаков В.Е. Сравнительный анализ эффективности открытой и эндоскопической декомпрессии срединного нерва при первичном синдроме карпального канала. Вопросы реконструктивной и пластической хирургии. 2019; 2 (69): 71–78.
43. Hudak P.L., Amadio P.C., Bombardier C. Development of an upper extremity outcome measure: The DASH (disabilities of the arm, shoulder and hand) [corrected]. The Upper Extremity Collaborative Group (UECG). Am J Ind Med. 1996; 29 (6): 602–608.
44. Levine D.W., Simmons B.P., Koris M.J., et al. A self-administered questionnaire for the assessment of severity of symptoms and functional status in carpal tunnel syndrome. J Bone Joint Surg Am. 1993; 75 (11): 1585–1592.
45. Гильвег А.С., Парфенов В.А., Евзиков Г.Ю. Ближайшие и отдаленные результаты декомпрессии срединного нерва при синдроме запястного канала. Неврология, нейропсихиатрия, психосоматика. 2018; 10 (3): 79–85.
46. Jeon I.-H. Simple in situ decompression for idiopathic cubital tunnel syndrome using minimal skin incision. Med Pregl. 2010; 63 (9–10): 601–606.
47. Kang H.J., Koh I.-K., Chun Y.-M., et al. Ulnar nerve stabilitybased surgery for cubital tunnel syndrome via a small incision: A comparison with classic anterior nerve transposition. J Orthop Surg Res. 2015; 10. DOI: 10.1186/s13018-015-0267-8
48. Джигания Р. Персонализированный выбор метода хирургического лечения нейропатии локтевого нерва на уровне кубитального канала: дис. … канд. мед. наук. СПб.; 2019.
Об авторах
М. В. ШпагинРоссия
Шпагин Максим Владимирович – кандидат медицинских наук, врач-нейрохирург
Нижний Новгород
А. В. Яриков
Россия
Яриков Антон Викторович – кандидат медицинских наук, врач-нейрохирург
Нижний Новгород
С. С. Павлов
Россия
Павлов Сергей Сергеевич – врач-нейрохирург
Нижний Новгород
А. А. Соколов
Россия
Соколов Артем Андреевич – студент 3-го курса
Нижний Новгород
Рецензия
Для цитирования:
Шпагин М.В., Яриков А.В., Павлов С.С., Соколов А.А. Применение лазеротерапии в комплексном лечении больных с компрессионно-ишемической невропатией. Лазерная медицина. 2021;25(1):36-44. https://doi.org/10.37895/2071-8004-2021-25-1-36-44
For citation:
Shpagin M.V., Yarikov A.V., Pavlov S.S., Sokolov A.A. Laser therapy in the complex treatment of patients with compression-ischemic neuropathy. Laser Medicine. 2021;25(1):36-44. (In Russ.) https://doi.org/10.37895/2071-8004-2021-25-1-36-44
JATS XML


























