Перейти к:
Экспериментальное исследование возможности использования «синего» (λ=50 нм) лазерного излучения для удаления пигментных образований
https://doi.org/10.37895/2071-8004-2023-27-3-21-35
Аннотация
Актуальность. Доброкачественные пигментные образования кожи, в том числе пигментные пятна, невусы, включая врожденные гигантские пигментные невусы (ВГПН), – это расположенные в различных слоях кожи патологические образования, состоящие из скопления меланоцитов – клеток, содержащих пигмент меланин. ВГПН представляют особую психологическую, эстетическую и медицинскую проблему, связанную с обширным изменением кожного покрова и изменением облика пациента.
В настоящее время существуют многочисленные методы лечения ВГПН и других пигментных образований кожи, в том числе с использованием лазерного излучения. Однако они часто неэффективны и приводят к неудовлетворительным клиническим и эстетическим результатам, при этом частота осложнений в виде рубцовой деформации и рецидива образования достигает 41 %. В связи с этим проблема эффективного и корректного лечения пигментных образований кожи продолжает оставаться актуальной и требует дальнейшего исследования.
Цель. Экспериментальное обоснование возможности использования лазерного излучения с длиной волны 450 нм для улучшения результатов лечения пигментных образований кожи, включая ВГПН у детей.
Материалы и методы. В работе использовали лазерное излучение «синего» диапазона с длиной волны 450 нм, близкой к пику поглощения меланина, гемоглобина и оксигемоглобина. Данное излучение генерирует диодный лазерный аппарат «Лазермед 10-03», разработанный для медицинских целей ООО «Русский инженерный клуб», г. Тула, Россия. Экспериментальное медико-биологическое исследование выполнено in vitro на охлажденных образцах печени и мышцах мини-свиньи и in vivo на пигментированной коже живой лабораторной крысы с морфометрической оценкой и изучения динамики регенеративного раневого процесса участков воздействия.
Результаты. На основании результатов выполненного экспериментального исследования определены оптимальные режимы лазерного излучения с длиной волны 450 нм для прецизионного удаления различных пигментных образований кожи.
Заключение. Лазерное излучение с длиной волны 450 нм является перспективным для эффективного лечения пигментных образований кожи, включая ВГПН, в том числе у пациентов детского возраста.
Ключевые слова
Для цитирования:
Подурар С.А., Горбатова Н.Е., Брянцев А.В., Золотов С.А., Дуванский В.А., Тертычный А.С., Варев Г.А. Экспериментальное исследование возможности использования «синего» (λ=50 нм) лазерного излучения для удаления пигментных образований. Лазерная медицина. 2023;27(3):21-35. https://doi.org/10.37895/2071-8004-2023-27-3-21-35
For citation:
Podurar S.A., Gorbatova N.Ye., Bryantsev A.V., Zolotov S.A., Duvanskiy V.A., Tertychny A.S., Varev G.A. An experimental study on the application of “blue” (λ = 450 nm) laser light to remove pigmented skin formations. Laser Medicine. 2023;27(3):21-35. (In Russ.) https://doi.org/10.37895/2071-8004-2023-27-3-21-35
Пигментные невусы (ПН) – это образования, состоящие из меланоцитов и представленные в виде родимых пятен различной формы и локализации. Впервые термин «невус», обозначающий пигментные образования кожи, применил R. Virchow в 1863 году [1]. Врожденные гигантские пигментные невусы (ВГПН) представляют собой кожные образования, расположенные в различных слоях кожи, занимающие обширные участки и состоящие из скопления меланоцитов различной степени дифференцировки.
ПН имеют нейроэктодермальный генез: на шестой неделе эмбриогенеза меланобласт начинает миграцию из неврального гребешка в структуры кожи [2]. Происхождение ВГПН вызвано мутацией в генах, кодирующих белки NRAS и KRAS в клетках организма, которые возникают на ранних стадиях эмбрионального развития в течение первых двенадцати недель беременности [3]. Выделяют группу простых, редких и врожденных гигантских пигментных невусов в соответствии с классификацией пигментных невусов [4]. По размеру ВГПН подразделяют на истинно гигантский (от 10 до 60 см и более), средний (от 1,5 до 10 см) и малый (до 1,5 см) [5].
Частота возникновения ВГПН, по данным разных авторов, варьирует от 1 на 20 000 до 1 на 500 000 новорожденных. ВГПН чаще локализуются на различных открытых участках тела: лице, туловище и нередко занимают обширные площади. Эти образования оказывают серьезное психологическое воздействие на пациента, связанное с изменением облика, и в связи с этим представляют значительную медицинскую и одновременно социальную проблему [6][7]. В течение жизни ребенка отмечают этапы резкого увеличения ВГПН в возрасте 4 и 7 лет, и особенно часто в период гормональной перестройки (в 76,8 % случаев). Возможны осложнения в результате травматического повреждения образования одеждой и предметами быта (23,2 %), избыточной инсоляции (64,9 %), которые могут привести к фрагментации и десквамации поверхности, воспалению и кровотечению, а также к малигнизации, чаще у взрослых пациентов (в 10–15 % случаев) [8].
В настоящее время удаление ПН осуществляют различными способами: хирургическим иссечением с кожной пластикой, методами криодеструкции и диатермокоагуляции (электрокоагуляции), механической и химической дермабразии и с помощью различного лазерного излучения.
Большинство из обозначенных выше многочисленных методов лечения имеют существенные недостатки: либо они недостаточно эффективны, либо вызывают избыточное термическое воздействие из-за невозможности контроля его глубины, что сопровождаются значительным повреждением тканевых структур и приводит к осложнениям [9][10].
Неудовлетворительные результаты лечения пигментных образований кожи, включая ВГПН, отмечают до 41 % случаев, с осложнениями в виде рубцовой деформации кожного покрова; рецидивы пигментных образований – до 6 % случаев [11][12].
На сегодня наиболее перспективным рассматривают удаление ПН с использованием различного лазерного излучения. Для лечения образований применяют пигментно-специфические лазерные аппараты: на рубине (λ = 694 нм), александрите (λ = 755 нм), иттрий-алюминий-гранате Nd: (YAG) – λ = 1064 нм), а также абляционные лазеры: эрбий YAG Er: YAG (λ = 2940 нм) и определенные режимы коротко импульсного лазерного излучения, например СО2-лазеров (λ = 10,6 нм) [13][14]. Однако при использовании указанных лазеров не исключено образование гипертрофических и келоидных рубцов, особенно в проблемных зонах, которые отмечают в 2–5 % случаев [15][16]. После выполнения лазерной дермабразии в зависимости от ее глубины возможно возникновение гиперпигментации до 21 % случаев и гипопигментации до 34 % случаев [17].
Таким образом, сохраняется актуальная проблема лечения различных пигментных образований кожи, что требует поиска новых высокоэффективных методов лечения на основе использования селективных свойств лазерного излучения к хромофорам кожи, что могло бы обеспечить избирательное удаление пигментных образований при минимальном повреждении окружающих тканевых структур.
В последнее время в литературе появились немногочисленные публикации по использованию лазерного излучения «синего» спектрального диапазона с длиной волны 450 нм, имеющей почти одинаково высокую степень поглощения меланином, гемоглобином и оксигемоглобином и очень низкое поглощение водой. Показатели поглощения представлены на рисунке 1. Глубина проникновения «синего» лазерного излучения с длиной волны 450 нм в ткани кожи относительно неглубока, в пределах эпидермиса и верхних слоев дермы (рис. 2).
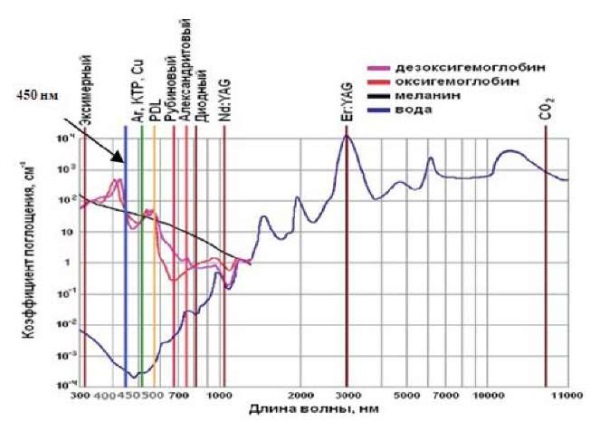
Рис. 1. Спектры поглощения лазерного излучения хромофорами кожи [18]
Fig. 1. Absorption spectra of laser radiation by skin chromophores [18]
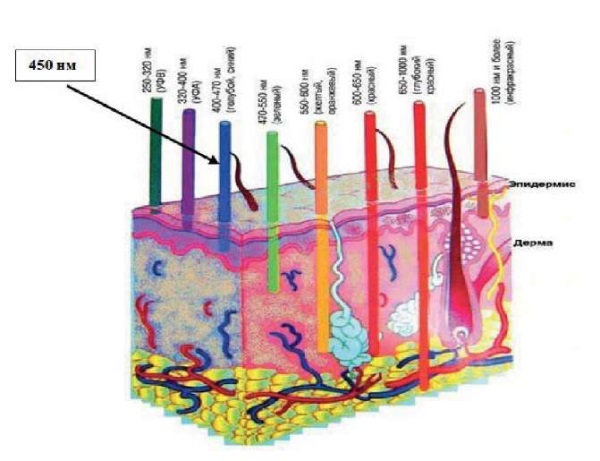
Рис. 2. Глубина проникновения лазерного излучения [18]
Fig. 2. Depth of laser light penetration [18]
Однако на сегодня исследования по воздействию лазерного излучения с длиной волны 450 нм на биологические объекты проводили лишь в экспериментах, а именно на сосудистых тканях куриных эмбрионов [19][20][21].
В связи с этим вопрос использования лазерного излучения синего спектрального диапазона с длиной волны 450 нм для удаления пигментных образований кожи, включая ВГПН, остается нерешенным, что создает необходимость выполнения экспериментальных исследований для определения оптимальных параметров данного лазерного излучения, обеспечивающих прецизионное и радикальное удаление тканей пигментных образований.
Целью работы является экспериментальное обоснование возможности использования лазерного излучения с длиной волны 450 нм для улучшения результатов лечения пигментных образований кожи, включая ВГПН у детей.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали лазерное излучение «синего» спектрального диапазона (λ = 450 нм), с мощностью до 10 Вт и диаметром пятна 0,6–1,5 мм, генерируемое в непрерывном и импульсном режиме диодным лазерным аппаратом «Лазермед 10–03», разработанным для медицинских целей в ООО «Русский инженерный клуб», г. Тула, Россия (рис. 3).
Рис. 3. Лазерный аппарат «Лазермед 10–03»
Fig. 3. Laser device “Lasermed 10–03”
Экспериментальное исследование включало два раздела: in vitro и in vivo.
В эксперименте in vitro задействовано две мини-свиньи: 24 образца охлажденных препаратов печени и мышечной ткани, выполнено исследование 24 макроскопических препаратов и 24 соответствующих гистологических препаратов.
В эксперименте in vivo в качестве биологической модели было задействовано 36 живых пигментированных черными пятнами лабораторных крыс в возрасте
6–8 месяцев, выполнено 168 экспериментальных проб пигментированной кожи, исследование 168 макроскопических и 168 соответствующих гистологических препаратов.
Образцы биотканей с зонами воздействия лазерного излучения (λ = 450 нм) для гистологического исследования фиксировали в 10 % нейтральном формалине. Дальнейшее исследование проводили в автоматическом режиме для гистологической проводки в аппарате фирмы Excelsior (Termo Scientific, Великобритания), заливали в парафин на аппарате ЕС350 (Microm, Германия). С парафиновых блоков получали срезы толщиной 2–3 мкм на микротоме НМ355S с системой переноса срезов STS (Termo Scientific, Великобритания). Гистопрепараты депарафинировали и выполняли окраску гематоксилином и эозином. Гистологические препараты просматривали в микроскопе СХ41 (Olympus, Япония). Микрофотографии гистологических препаратов получали сканированием на микроскопе Pannoramic Midi (3DHISTECH, Венгрия) и изучали при различном увеличении полученное полноценное изображение с анализом и интерпретацией результатов. Гистологическое исследование зон лазерного воздействия проводили с оценкой морфометрических параметров и замером участков поврежденных тканей.
Методика выполнения экспериментального исследования in vitro
На охлажденные образцы печени через ее капсулу и на мышцы воздействовали в импульсном и непрерывном режиме единичными импульсами с неподвижным лазерным пятном излучения (λ = 450 нм).
В непрерывном режиме использовали режимы мощности излучения (λ = 450 нм): 1,0, 3,0, 6,0 и 10,0 Вт, время воздействия было постоянным – 1 секунда, диаметр лазерного пятна на поверхности объекта – 1,0 мм.
В импульсном режиме на образцы воздействовали лазерным излучением в импульсном режиме, с неподвижным лазерным пятном диаметром 1,0 мм на поверхности объекта. Использовали переменные параметры лазерного излучения (λ = 450 нм): мощности (1,0, 3,0, 6,0 и 10,0 Вт), а также длительность импульса 0,5 сек. и расстояние между импульсами 0,5 сек.
При выполнении эксперимента изучали визуально определяемые макроскопические изменения в зонах воздействия на поверхности указанных образцов. В дальнейшем было выполнено гистологическое исследование соответствующих препаратов.
Методика выполнения экспериментального исследования in vivo
В эксперименте in vivo в качестве биологической модели было задействовано 36 пигментированных черными пятнами лабораторных крыс в возрасте 6–8 месяцев.
Предварительно живую лабораторную крысу взвешивали, затем вводили анестезиологический препарат по инструкции. Эксперименты проведены под общим обезболиванием, анестезиологическим пособием: препаратом «Золетил» из расчета 0,1 мл на 100 мг веса лабораторного животного путем внутримышечного введения. В области спины проводили эпиляцию кожного покрова с помощью электробритвы (фирмы Moser) насадкой под 0, затем кожу спины обрабатывали неспиртовыми антисептическими растворами (хлоргексидин или мирамистин).
На кожу воздействовали лазерным излучением (λ = 450 нм) с постоянными параметрами диаметра лазерного пятна 1,0 мм и с постоянной скоростью однократного сканирования 0,5 см в 1 секунду по поверхности зоны объекта.
В непрерывном режиме лазерного излучения использовали переменные параметры мощности: 3,0, 6,0 и 10,0 Вт. Параметры режимов непрерывного лазерного излучения (λ = 450 нм), использованные в эксперименте in vivo представлены в таблице 1. Соответствующие им зоны воздействия на коже спины лабораторных крыс обозначены стрелочками с нумерацией режимов и представлены на рисунке 4.
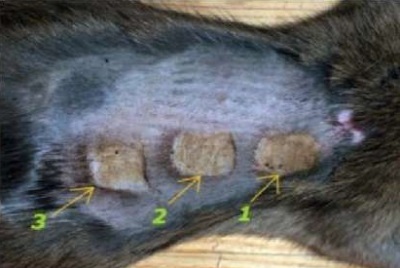
Рис. 4. Зоны воздействия при непрерывном режиме
Fig. 4. Zones irradiated in the continuous mode
Таблица 1
Режимы воздействия непрерывного режима
Table 1
Modes of irradiation in the continuous mode
Режим № Mode No | Мощность, Вт Power, W |
1 | 3 |
2 | 6 |
3 | 10 |
В импульсном режиме лазерного излучения (λ = 450 нм) с постоянной длительностью импульса 0,5 сек. использовали переменные параметры: интервал между импульсами 0,5, 0,25 и 0,1 сек. и мощность 3,0, 6,0 и 10,0 Вт. Параметры режимов импульсного лазерного излучения (λ = 450 нм), использованные в эксперименте, представлены в таблице 2. Соответствующие им зоны воздействия на коже спины лабораторных крыс обозначены стрелочками с нумерацией режимов и представлены на рисунке 5.
Таблица 2
Режимы воздействия импульсного излучения
Table 2
Modes of impact of pulsed irradiation
Режим № Mode No | Мощность, Вт Power, W | Время между импульсами, сек. Time between pulses, sec |
1–3 | 3 | 0,5; 0,25; 0,1 |
4–6 | 6 | 0,5; 0,25; 0,1 |
7–9 | 10 | 0,5; 0,25; 0,1 |
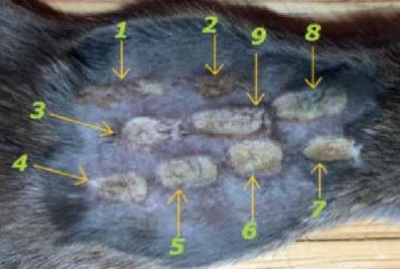
Рис. 5. Зоны воздействия при импульсном режиме
Fig. 5. Zones irradiated in the pulsed mode
Забор экспериментального материала для гистологического исследования осуществляли сразу после воздействия, на 4, 7, 12, 21, 30 и 90-е сутки методом хирургического иссечения под общим обезболиванием препаратом «Золетил». Лабораторное животное выводили из эксперимента путем гуманной эвтаназии с увеличением дозы данного препарата (согласно руководству и материалам Федерации европейских научных ассоциаций по лабораторным животным: FELASA).
При выполнении эксперимента изучали визуально определяемые макроскопические изменения в зонах воздействия на поверхности указанных образцов, фиксировали фотодокументированием. Далее из макропрепаратов кожи готовили соответствующие гистопрепараты для последующего исследования. В течение всего периода наблюдения за биологическими моделями на основании результатов макроскопического и гистологического исследования изучали состояние тканей и особенность течения регенеративного раневого процесса в зонах воздействия.
РЕЗУЛЬТАТЫ
Результаты макроскопического исследования образцов печени
Было определено, что при всех использованных параметрах лазерного излучения наличие округлых дефектов-кратеров с коагуляционным коричнево-желтого цвета венчиком вокруг. Размеры их увеличиваются от 0,5 до 2,0 мм при большей энергетике непрерывного режима, причем при импульсном режиме и мощности 1,0 Вт видимый эффект отсутствует.
Отмечено, что при использовании импульсного режима на печени образуются дефекты значительно меньшего размера от 0,3 до 1,5 мм, чем при применении непрерывного режима при сравнимых параметрах излучения. Примеры представлены на рисунках 6 (А, Б, В, Г) и 7 (А, Б, В, Г).

Рис. 6. Воздействие на охлажденные образцы печени свиньи
в импульсном режиме: А – 1 Вт, Б – 3 Вт, В – 6 Вт, Г – 10 Вт
Fig. 6. Cooled pig liver samples irradiated in the pulsed mode:
A – 1 W, Б – 3 W, В – 6 W, Г – 10 W
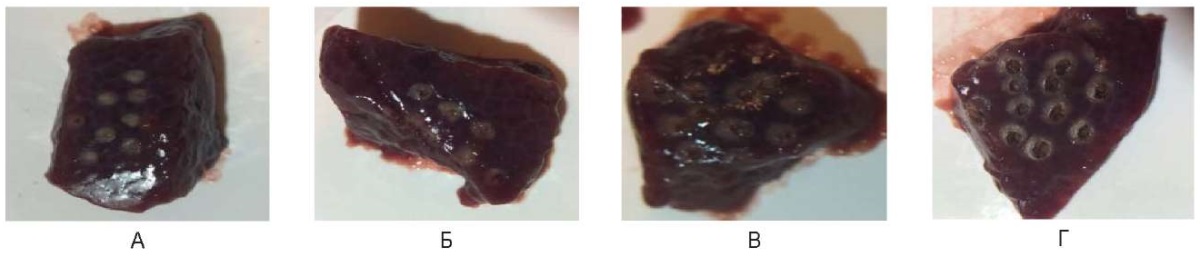
Рис. 7. Воздействие на охлажденные образцы печени свиньи
в непрерывном режиме: А – 1 Вт, Б – 3 Вт, В – 6 Вт, Г – 10 Вт
Fig. 7. Cooled pig liver samples irradiated in the continuous mode:
A – 1 W, Б – 3 W, В – 6 W, Г – 10 W
Результаты гистоморфологического исследования ткани печени, на основании которых были определены особенности воздействия лазерного излучения (λ = 450 нм) в непрерывном и импульсном режиме.
Лазерное излучение (λ = 450 нм) в непрерывном режиме при обозначенных параметрах мощности оказывает выраженное термическое повреждение на ткань печени. В зонах воздействия присутствуют все участки деструктивных и распространенных повреждений, характерные для лазерного излучения, шириной на поверхности до 1150,0 ± 250,0 мкм, глубиной до 230,0 ± 100,0 мкм. Проявления их сходные при использованных параметрах мощности и усиливаются до образования значительного размера минусового дефекта-кратера при непрерывном воздействии с мощностью 10,0 Вт (рис. 8).
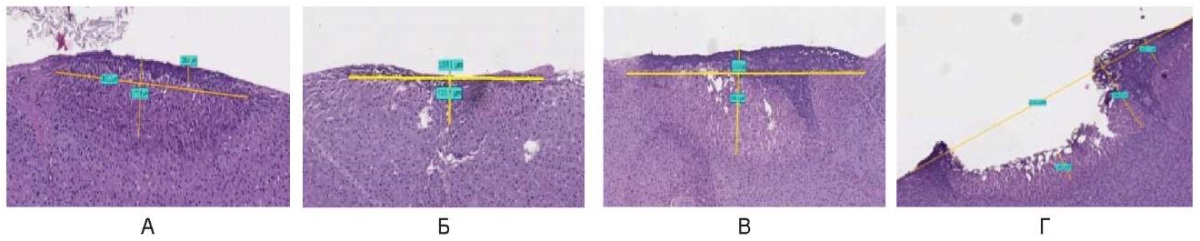
Рис. 8. Воздействие на охлажденные образцы печени свиньи
в непрерывном режиме: А – 1 Вт, Б – 3 Вт, В – 6 Вт, Г – 10 Вт
Fig. 8. Cooled pig liver samples irradiated in the continuous mode:
A – 1 W, Б – 3 W, В – 6 W, Г – 10 W
В импульсном режиме лазерное излучение (λ = 450 нм) формирует термическое повреждение в виде широких до 1350,0 ± 150,0 мкм деструктивных изменений, представленных на поверхности тонким слоем 45,0 ± 5,0 мкм компактного коагуляционного некроза, под которым присутствует слой гомогенизированной ткани до 200,0 мкм ± 50 мкм (рис. 9).
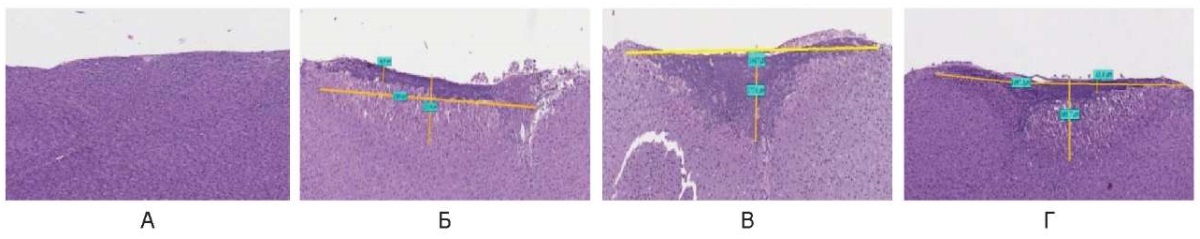
Рис. 9. Воздействие на охлажденные образцы печени свиньи
в импульсном режиме: А – 1 Вт, Б – 3 Вт, В – 6 Вт, Г – 10 Вт
Fig. 9. Cooled pig liver samples irradiated in the pulsed mode:
A – 1 W, Б – 3 W, В – 6 W, Г – 10 W
Таким образом, импульсный режим по сравнению с непрерывным режимом при всех сравнимых параметрах имеет схожее воздействие, которое носит прогнозируемый стабильный характер повреждения, глубиной 250,0 мкм ± 50 мкм, но более выраженный по интенсивности компактного коагуляционного эффекта на поверхности.
Макроскопическое исследование образцов мышц
При всех использованных параметрах непрерывного режима было отмечено образование округлой формы слегка заглубленной бело-желтого цвета поверхности, размеры которой увеличиваются от 0,5 до 2,5 мм с нарастанием мощности. В центре зоны воздействия при 6,0 Вт присутствовал более темного цвета, точечный, минусовой дефект до 0,2 мм, более выраженный при 10,0 Вт (рис. 10).
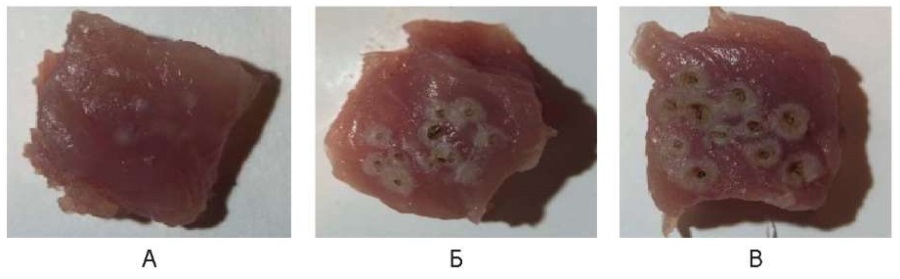
Рис. 10. Воздействие на охлажденные образцы мышц свиньи
в непрерывном режиме: А – 3 Вт, Б – 6 Вт, В – 10 Вт
Fig. 10. Cooled pig muscle samples irradiated in the continuous mode:
A – 1 W, Б – 3 W, В – 6 W, Г – 10 W
В импульсном режиме при мощности 3,0 Вт определен незначительный эффект воздействия в виде слегка беловатой поверхности диаметром не более 0,5 мм. При использовании мощности 6,0 Вт и 10,0 Вт отмечено наличие поверхностных округлых беловато-желтого цвета дефектов диаметром 1,0 и 2,0 мм соответственно, минус-ткань в центре не определяется (рис. 11).

Рис. 11. Воздействие на охлажденные образцы мышц свиньи
в импульсном режиме: А – 3 Вт, Б – 6 Вт, В – 10 Вт
Fig. 11. Cooled pig muscle samples irradiated in the pulsed mode:
A – 1 W, Б – 3 W, В – 6 W, Г – 10 W
Сравнительный анализ макропрепаратов мышц определил, что при использовании указанных параметров импульсного режима по сравнению с непрерывным режимом излучения на мышцах образуются значительно меньшего размера дефекты, чем при применении последнего.
Гистоморфологическое исследование результата воздействия лазерного излучения (λ = 450 нм) на мышечную ткань
При использовании непрерывного режима (λ = 450 нм) отмечен выраженный термический эффект, который носит поверхностный характер в виде тонкого слоя компактного коагуляционного некроза, средней глубиной до 250,0 ± 120,0 мкм, без повреждения подлежащих миоцитов (рис. 12).
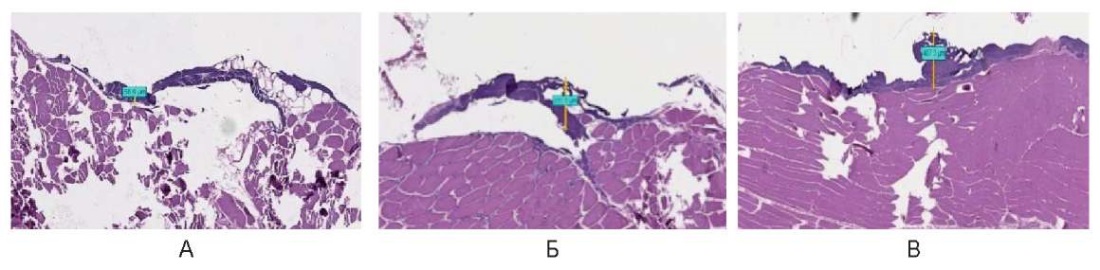
Рис. 12. Воздействие на охлажденные образцы мышц свиньи
в непрерывном режиме: А – 3 Вт, Б – 6 Вт, В – 10 Вт
Fig. 12. Cooled pig muscle samples irradiated in the continuous mode:
A – 1 W, Б – 3 W, В – 6 W, Г – 10 W
В импульсном режиме использование лазерного излучения (λ = 450 нм) термическое повреждение выявлено только при увеличении мощности до 6,0 Вт в виде тонкого слоя компактного коагуляционного некроза на поверхности средней глубиной 190,0 мкм ± 20,0 мкм (рис. 13).
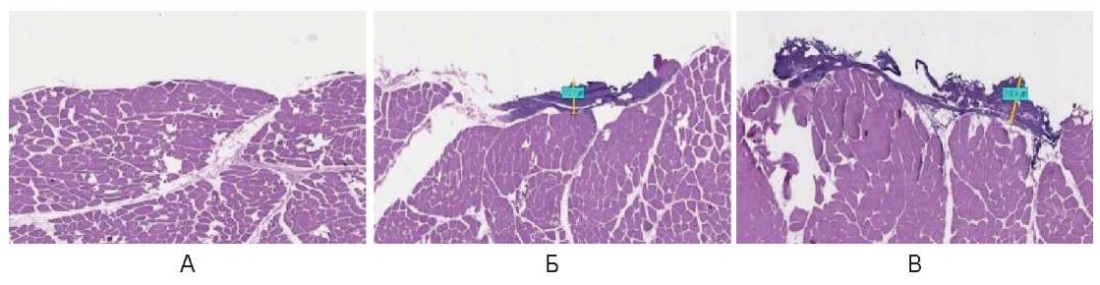
Рис. 13. Воздействие на охлажденные образцы мышц свиньи
в импульсном режиме: А – 3 Вт, Б – 6 Вт, В – 10 Вт
Fig. 13. Cooled pig muscle samples irradiated in the pulsed mode:
A – 1 W, Б – 3 W, В – 6 W, Г – 10 W
Таким образом, импульсный и непрерывный режим при всех указанных параметрах имеет схожее термическое воздействие на мышечную ткань, которое носит стабильно неглубокий характер повреждения, при использовании импульсного режима оно более поверхностное по сравнению с непрерывным режимом.
In vivo
Результаты сравнительного анализа использования лазерного излучения с длиной волны 450 нм в импульсном режиме с мощностью 3,0 Вт и интервалом между импульсами 0,1, 0,25 и 0,5 сек. определили, что образующиеся участки коагуляционного некроза при времени между импульсами 0,5 сек. более выраженные и большей глубины до 336 ± 15,0 мкм по сравнению с другими указанными периодами тепловой релаксации. В свою очередь, при использовании времени между импульсами 0,25 сек. по сравнению с 0,1 сек. отмечено наличие более гармоничных и менее выраженных коагуляционных изменений, глубиной до 150,0 ± 10,0 мкм (рис. 14).
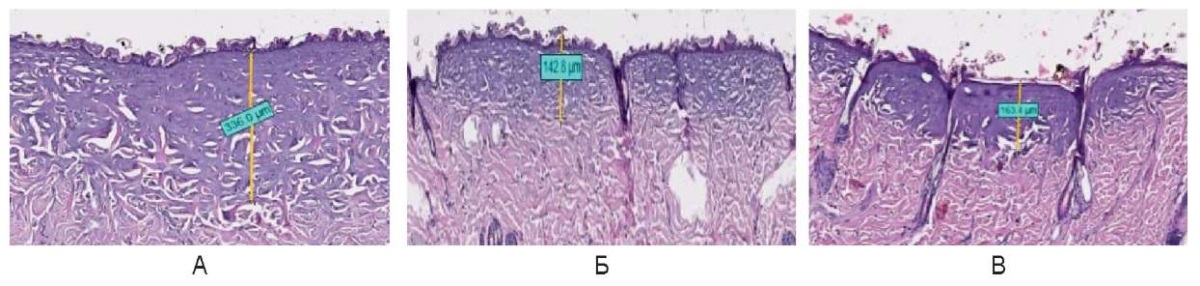
Рис. 14. Гистологическая картина воздействия
на кожу спины живой лабораторной крысы
сразу после воздействия в импульсном режиме: мощность 3 Вт,
интервал между импульсами А – 0,5 сек., Б – 0,25 сек., В – 0,1 сек.
Fig. 14. Histological picture of the back skin of a live laboratory rat
immediately after laser light irradiation in the pulsed mode:
power 3 W, interval between pulses A – 0.5 sec, Б – 0.25 sec, В – 0.1 sec.
Таким образом, на основании результатов сравнительного анализа использования выше указанных параметров лазерного излучения λ = 450 нм в импульсном режиме при мощности 3,0 Вт было определено, что оптимальным для дальнейшего экспериментального исследования являются длительность импульса 0,5 сек и время между импульсами 0,25 сек.
Особенности макроскопических изменений сразу после воздействия и до 90 суток после воздействия лазерного излучения с длиной волны 450 нм
Сразу после воздействия излучения определяется светлый ровный участок поверхности, выполненной беловато-желтой коагуляционной корочкой. При использовании большей энергетической активности и непрерывном режиме излучения данная послеоперационная корочка более плотная и интенсивнее окрашена в желто-коричневый цвет, с 12-х суток отмечено ее частичное отторжение с краев, причем при использовании непрерывного режима она сохраняется дольше – до 21-х суток, полное отторжение которой при всех режимах определяется на 30-е сутки. Эпителизация раневой поверхности отчетливо определяется с 21-х суток, все зоны воздействия представлены светлой кожей без пигментации, которая присутствует и на 90-е сутки. Воспалительные проявления на всех сроках наблюдения отсутствуют.
Примеры макроскопических изменений на разных сроках в зонах воздействия лазерного излучения λ = 450 нм при использовании непрерывных и импульсных режимов представлены на рисунках 15–19.
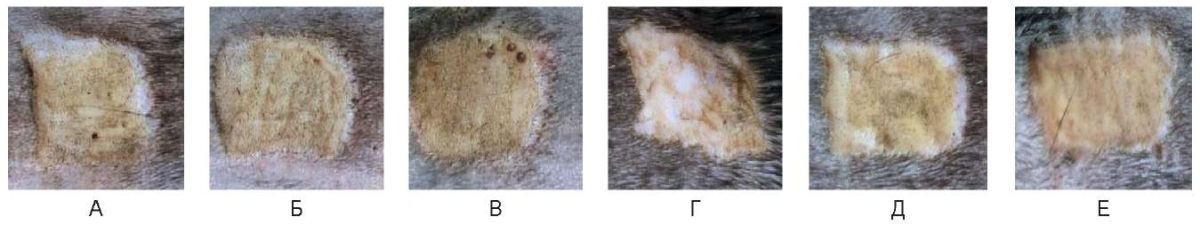
Рис. 15. Воздействие на кожу спины живой лабораторной крысы
сразу после воздействия:
А –3 Вт, Б – непрерывный режим 6 Вт, В – непрерывный режим 10 Вт,
Г – импульсный режим 3 Вт, Д – импульсный режим 6 Вт, Е – импульсный режим 10 Вт
Fig. 15. The back skin of a live laboratory rat immediately after exposure:
A – 3 W; Б – continuous mode 6 W; В – continuous mode 10 W;
Г– pulsed mode 3 W; Д – pulsed mode 6 W; E – pulsed mode 10 W
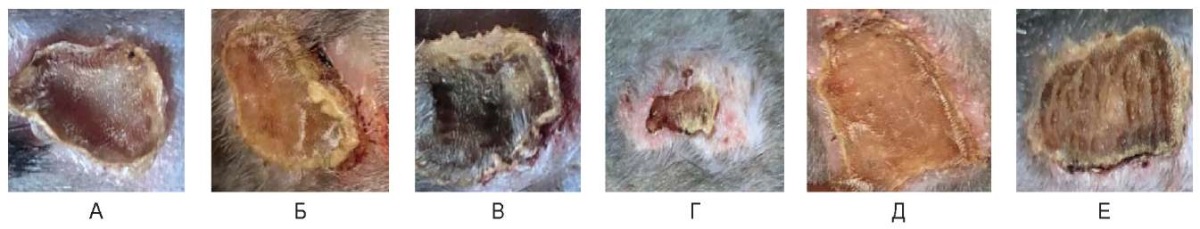
Рис. 16. Воздействие на кожу спины живой лабораторной крысы на 12-е сутки:
А – 3 Вт, Б – непрерывный режим 6 Вт, В – непрерывный режим 10 Вт,
Г – импульсный режим 3 Вт, Д – импульсный режим 6 Вт, Е – импульсный режим 10 Вт
Fig. 16. The back skin of a live laboratory rat on day 12 after exposure:
A – 3 W; Б – continuous mode 6 W; В – continuous mode 10 W;
Г– pulsed mode 3 W; Д – pulsed mode 6 W; E – pulsed mode 10 W
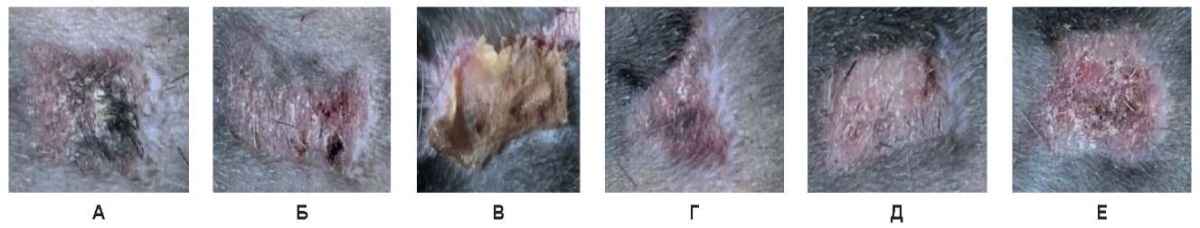
Рис. 17. Воздействие на кожу спины живой лабораторной крысы на 21-е сутки:
А –3 Вт, Б – непрерывный режим 6 Вт, В – непрерывный режим 10 Вт,
Г – импульсный режим 3 Вт, Д – импульсный режим 6 Вт, Е – импульсный режим 10 Вт
Fig. 17. The back skin of a live laboratory rat on day 21 after exposure:
A – 3 W; Б – continuous mode 6 W; В – continuous mode 10 W;
Г– pulsed mode 3 W; Д – pulsed mode 6 W; E – pulsed mode 10 W
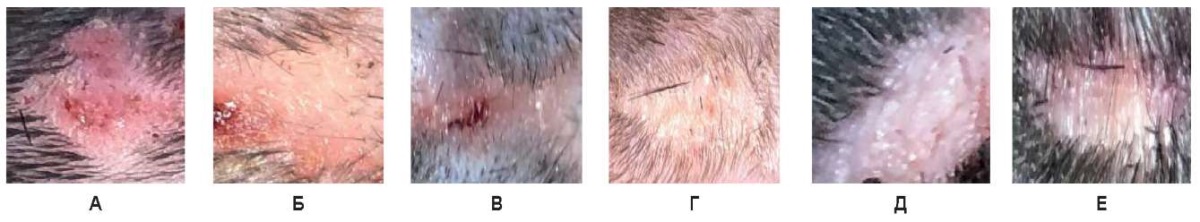
Рис. 18. Воздействие на кожу спины живой лабораторной крысы на 30-е сутки:
А –3 Вт, Б – непрерывный режим 6 Вт, В – непрерывный режим 10 Вт,
Г – импульсный режим 3 Вт, Д – импульсный режим 6 Вт, Е – импульсный режим 10 Вт
Fig. 18. The back skin of a live laboratory rat on day 30 after exposure:
A – 3 W; Б – continuous mode 6 W; В – continuous mode 10 W;
Г– pulsed mode 3 W; Д – pulsed mode 6 W; E – pulsed mode 10 W
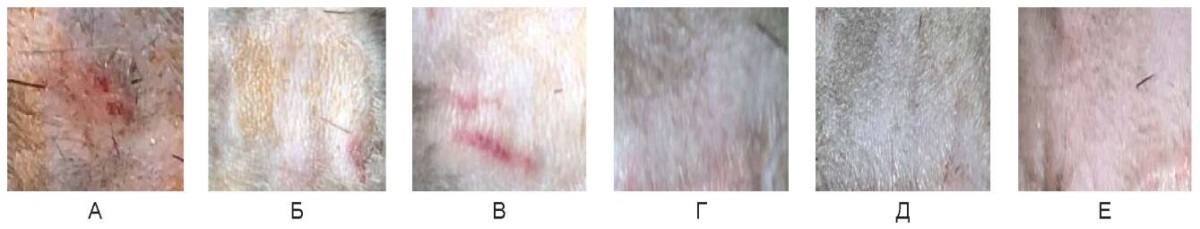
Рис. 19. Воздействие на кожу спины живой лабораторной крысы на 90-е сутки:
А –3 Вт, Б – непрерывный режим 6 Вт, В – непрерывный режим 10 Вт,
Г – импульсный режим 3 Вт, Д – импульсный режим 6 Вт, Е – импульсный режим 10 Вт
Fig. 19. Thed back skin of a live laboratory rat on day 90 after exposure:
A – 3 W; Б – continuous mode 6 W; В – continuous mode 10 W;
Г– pulsed mode 3 W; Д – pulsed mode 6 W; E – pulsed mode 10 W
Во всех случаях сразу после воздействия поверхность светло-желтого цвета, ровная, выполнена тонкой сухой коагуляционной корочкой, пигментация не определяется.
На 12-е сутки при всех непрерывных режимах поверхность зоны воздействия выполнена сухой желто-серого цвета коагуляционной корочкой, частично отторгшейся с краев, в окружающих тканях – незначительные воспалительные проявления.
При импульсном режиме с мощностью 3,0 Вт в центре сохраняется небольшая коагуляционная корочка, на месте ее отторжения – светлая кожа; при 6,0 и 10,0 Вт поверхность выполнена сухой коагуляционной корочкой желто-коричневого цвета, частично отторгающейся у краев.
На 21-е сутки при всех непрерывных и импульсных режимах, кроме мощности 10,0 Вт непрерывного режима, в зоне воздействия отмечено полное отторжение послеоперационной корочки, наличие светлой кожи без пигментации, эпителиальная выстилка сохранена, признаков воспаления нет. При 10,0 Вт непрерывного режима присутствует сухая желтого цвета коагуляционная корочка, отторгающаяся с краев.
При всех использованных непрерывных и импульсных режимах в зоне воздействия на 30-е сутки отмечена светлая кожа без пигментации, деформации кожного покрова нет, в окружающих тканях воспалительные проявления не определяются.
На 90-е сутки в зонах воздействия во всех случаях отмечается светлая эпителизированная кожа без пигментации, деформация поверхности не определяется.
Гистологическая картина в зонах воздействия лазерного излучения λ = 450 нм
Сразу после воздействия в непрерывном режиме определяется на поверхности тонкий участок компактного коагуляционного некроза средней толщиной 10,0 мкм ± 5,0 мкм, далее участок коагуляционного гомогенного некроза средней толщиной 550,0 ± 250,0 мкм с переходом в неизмененную ткань. Придатки кожи с коагуляционными изменениями сохраняются в основном в более глубоких подлежащих участках кожи, единичные до поверхности. Более выраженные коагуляционные изменения отмечены при увеличении мощности до 10,0 Вт до подкожно-жировой клетчатки, где сохраняются придатки кожи с коагуляционными изменениями, карбонизация не определяется (рис. 20).
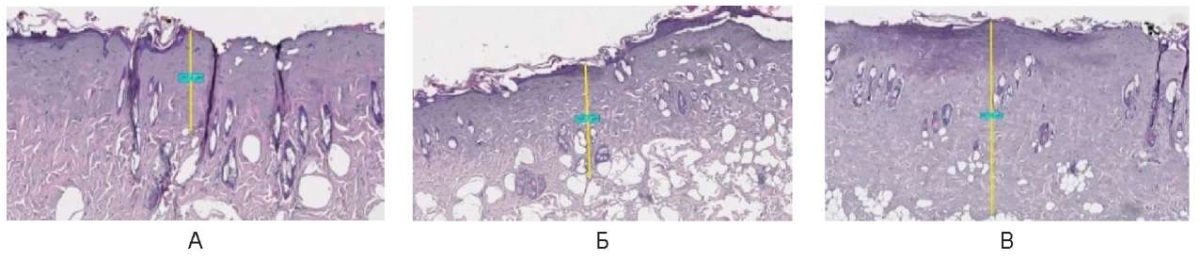
Рис. 20. Воздействие на кожу спины живой лабораторной крысы
сразу после воздействия в непрерывном режиме: А – 3 Вт, Б – 6 Вт, В – 10 Вт
Fig. 20. The back skin of a live laboratory rat
immediately after exposure in the continuous mode: A – 3 W; Б – 6 W; В – 10 W
При воздействии в импульсном режиме поверхность представлена коагуляционным некрозом толщиной 275,0 ± 125,0 мкм, придатки кожи сохраняются частично в зоне некроза, прослеживаются до поверхности, карбонизации нет. С увеличением мощности толщина и плотность коагуляционных изменений увеличиваются незначительно (рис. 21).

Рис. 21. Воздействие на кожу спины живой лабораторной крысы
сразу после воздействия в импульсном режиме: А – 3 Вт, Б – 6 Вт, В – 10 Вт
Fig. 21. The back skin of a live laboratory rat
immediately after exposure in the pulsed mode: A – 3 W; Б – 6 W; В – 10 W
На 12-е сутки при непрерывном режиме с мощностью 3,0 Вт зона воздействия выполнена восстановившимся эпидермисом и базальным слоем эпителия с множественными кератиноцитами, толщиной 365,0 мкм. Структура кожи сохранена, включая единичные придатки. При мощности 6,0 и 10,0 Вт зона воздействия выполнена коагуляционным некрозом, средней толщиной 625,0 ± 25,0 мкм. Эпителий деструктурирован, гомогенизирован (рис. 22).
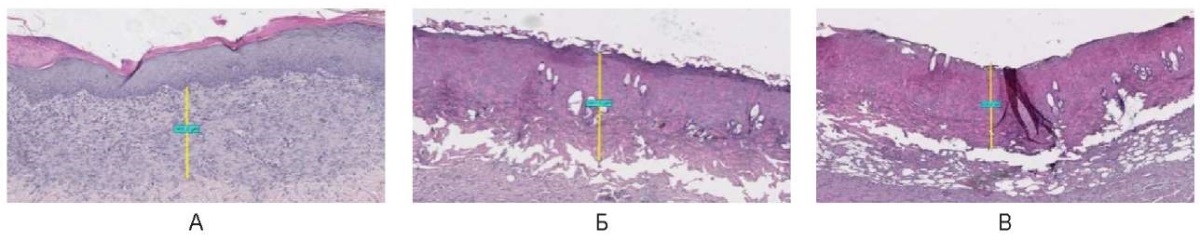
Рис. 22. Воздействие на кожу спины живой лабораторной крысы
на 12-е сутки в непрерывном режиме: А – 3 Вт, Б – 6 Вт, В – 10 Вт
Fig. 22. The back skin of a live laboratory rat
on day 12 after exposure in the continuous mode: A – 3 W; Б – 6 W; В – 10 W
При импульсном режиме с мощностью 3,0 Вт зона воздействия на 12-е сутки выполнена восстановившимся эпидермисом и базальным слоем эпителия толщиной 120,0 мкм. Структура кожи сохранена, включая множественные ее придатки. При мощности 6,0 и 10,0 Вт зона воздействия представлена коагуляционным некрозом средней толщиной 450,0 ± 75,0 мкм. Под зоной некроза определяется подкожно-жировая клетчатка с коагуляционными изменениями, придатки кожи единичные с коагуляционными изменениями (рис. 23).
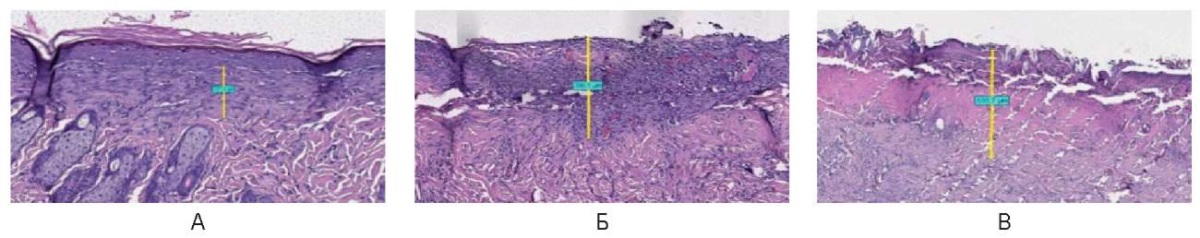
Рис. 23. Воздействие на кожу спины живой лабораторной крысы
на 12-е сутки в импульсном режиме: А – 3 Вт, Б – 6 Вт, В – 10 Вт
Fig. 22. The back skin of a live laboratory rat
on day 12 after exposure in the pulsed mode: A – 3 W; Б – 6 W; В – 10 W
На 21-е сутки при непрерывном режиме зона воздействия выполнена восстановившимся эпидермисом и эпителием с множественными кератиноцитами средней толщиной 500,0 ± 200,0 мкм. С увеличением мощности до 6,0 и 10,0 Вт определяется слой гиперкератоза и акантоза. Под эпителием относительно широкий слой хаотично расположенных и организующихся параллельно поверхности коллагеновых волокон (рис. 24).
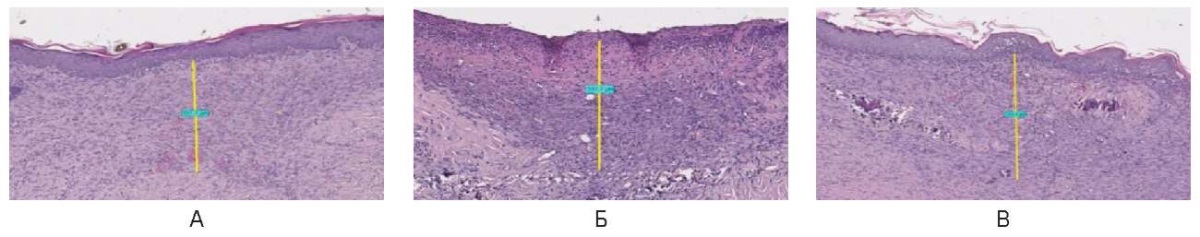
Рис. 24. Воздействие на кожу спины живой лабораторной крысы
на 21-е сутки в непрерывном режиме: А – 3 Вт, Б – 6 Вт, В – 10 Вт
Fig. 24. The back skin of a live laboratory rat
on day 21 after exposure in the continuous mode: A – 3 W; Б – 6 W; В – 10 W
При импульсном режиме зона воздействия на 21-е сутки выполнена восстановившимся эпидермисом и эпителием с множественными кератиноцитами толщиной 350,0 ± 100,0 мкм. Отмечено полное восстановление всех слоев эпителия и его придатков, базальная клеточная зона роста отчетливая ровная. Под эпителием определяется зона частично правильно организованных параллельно поверхности коллагеновых волокон (рис. 25).
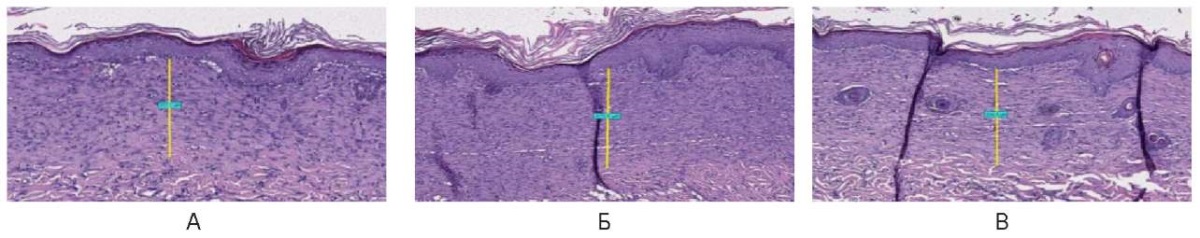
Рис. 25. Воздействие на кожу спины живой лабораторной крысы
на 21-е сутки в импульсном режиме: А – 3 Вт, Б – 6 Вт, В – 10 Вт
Fig. 25. The back skin of a live laboratory rat
on day 21 after exposure in the pulsed mode: A – 3 W; Б – 6 W; В – 10 W
К 21-м суткам при всех режимах отмечается полное восстановление эпителиального слоя и организация под ним зоны коллагеноза из организующейся параллельной поверхности коллагеновых волокон, причем толщина этого слоя практически не зависит от использованного режима мощности.
На 30-е сутки при использовании непрерывного режима структура кожи восстановлена полностью, включая придатки. Отмечается гиперкератоз на поверхности, выраженный акантоз. Под эпителием относительно широкий слой организованных параллельно поверхности коллагеновых волокон толщиной 600,0 ± 50,0 мкм (рис. 26).
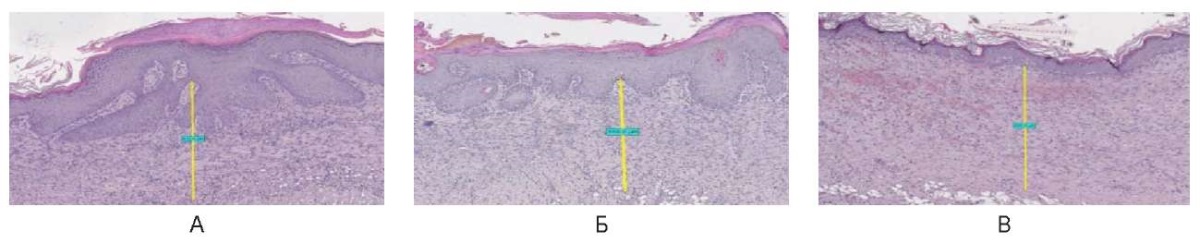
Рис. 26. Воздействие на кожу спины живой лабораторной крысы
на 30-е сутки в непрерывном режиме: А – 3 Вт, Б – 6 Вт, В – 10 Вт
Fig. 26. The back skin of a live laboratory rat
on day 30 after exposure in the continuous mode: A – 3 W; Б – 6 W; В – 10 W
В импульсном режиме при всех параметрах мощности отмечено полное восстановление всех слоев эпителия и его придатков, базальная клеточная зона роста отчетливая ровная, отмечается незначительный гиперкератоз на поверхности. Под эпителием присутствует зона коллагеновых волокон, расположенных параллельно поверхности, толщина слоя коллагеноза при всех режимах мощности почти одинаковая и равна 450,0 мкм ± 50,0 мкм (рис. 27).
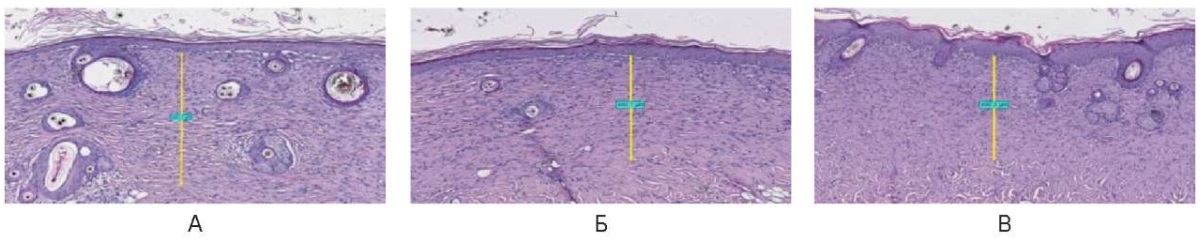
Рис. 27. Воздействие на кожу спины живой лабораторной крысы
на 30-е сутки в импульсном режиме: А – 3 Вт, Б – 6 Вт, В – 10 Вт
Fig. 27. The back skin of a live laboratory rat
on day 30 after exposure in the pulsed mode: A – 3 W; Б – 6 W; В – 10 W
Таким образом, к 30-м суткам при всех режимах отмечено полное восстановление эпителиального слоя и организация под ним зоны коллагеноза из параллельной поверхности коллагеновых волокон, причем толщина слоя повреждения практически не зависит от использованного режима мощности. В случае применения непрерывного режима проявления восстановительных регенеративных изменений (акантоз, гиперкератоз и других) более выраженные в ответ на более агрессивное воздействие.
На 90-е сутки при использовании непрерывного режима зона воздействия выполнена восстановившимся эпидермисом и под ним равномерно параллельно расположенными коллагеновыми волокнами толщиной слоя до 500,0 мкм ± 150,0 мкм (рис. 28).
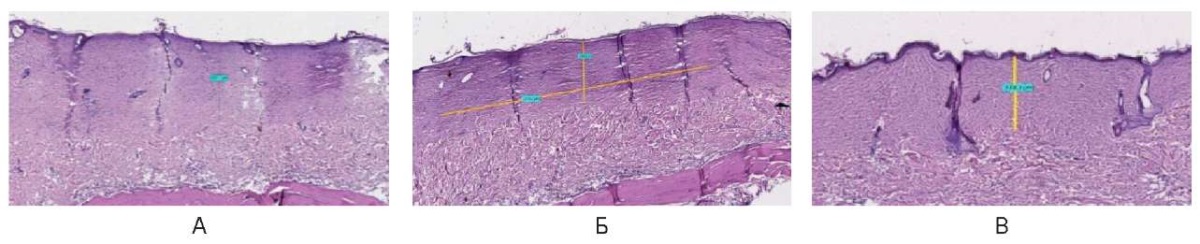
Рис. 28. Воздействие на кожу спины живой лабораторной крысы
на 90-е сутки в непрерывном режиме: А – 3 Вт, Б – 6 Вт, В – 10 Вт
Fig. 28. The back skin of a live laboratory rat
on day 90 after exposure in the continuous mode: A – 3 W; Б – 6 W; В – 10 W
При применении импульсного режима зона воздействия выполнена восстановившимся эпидермисом и хорошо организованным участком с равномерно параллельно расположенными коллагеновыми волокнами толщиной слоя до 800,0 ± 50,0 мкм (рис. 29).
Таким образом, на 90-е сутки при всех использованных режимах лазерного излучения (λ = 450 нм) отмечено полное восстановление эпителия, последний слегка утолщен, его придатки хорошо определяются, под ним широкий слой правильно ориентированных параллельно поверхности кожи коллагеновых волокон средней толщиной 700 ± 150,0 мкм.

Рис. 29. Воздействие на кожу спины живой лабораторной крысы
на 90-е сутки в импульсном режиме: А – 3 Вт, Б – 6 Вт, В – 10 Вт
Fig. 29. The back skin of a live laboratory rat
on day 90 after exposure in the pulsed mode: A – 3 W; Б – 6 W; В – 10 W
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В результате экспериментального исследования in vitro отмечено: лазерное излучение с длиной волны 450 нм оказывает прогнозируемое относительно неглубокое термическое повреждение биологических тканей, от 200 до 450 мкм, увеличивающееся в соответствии с увеличением мощности.
Лазерное излучение (λ = 450 нм) вызывает термическое повреждение ткани печени с образованием всех участков термического повреждения, свойственных лазерному воздействию, проявления которых сходны при использованных параметрах, менее выраженные при импульсном режиме, и усиливаются до образования минусового дефекта-кратера при непрерывном воздействии с мощностью 10,0 Вт.
Воздействие при использовании сравнимых параметров лазерного излучения с длиной волны 450 нм на ткань печени боле выраженное по сравнению с мышечной тканью.
На основании анализа серии исследования in vivo по воздействию лазерного излучения с длиной волны 450 нм в непрерывном и импульсном режиме отмечены:
- минимальные термические повреждения в виде коагуляционного участка повреждения эпителия с почти полным сохранением не измененных придатков кожи наблюдаются к 12-м суткам при мощности 3,0 Вт;
- значительно более выраженные термические повреждения определены при мощности 6,0 и 10,0 Вт, которые представлены участком компактного коагуляционного некроза с деструктуризацией и проявлениями ячеистого некроза, ниже с термическими изменениями подлежащей ткани;
- полное восстановление эпителиальных структур при мощности 3,0 Вт отмечено к 12-м суткам, и при мощности 6,0 и 10 Вт – к 21-м и 30-м суткам;
- воспалительный раневой процесс носит асептический характер, свойственный лазерным ранам, и сопоставим с соответствующими физиологическими сроками;
- глубина термического повреждения незначительно увеличивается с увеличением мощности, в среднем составляет 425 нм, в процессе наблюдения глубина повреждения не нарастает.
Воздействие на пигментированные ткани осуществляли «синим» лазерным излучением с длиной волны (λ = 450 нм), имеющим высокий коэффициент селективного поглощения меланином и гемоглобином, в меньшей степени водой. Этот феномен обеспечивает послойное и прогнозируемое удаление тканей пигментных образований с сохранением проксимальных участков придатков кожи. Данный факт обеспечивает «центральную» эпителизацию, заживление раневой поверхности в физиологические сроки, площадь которой в этом случае не ограничена установленными критериями и может быть относительно большой, а также минимальное повреждение подлежащих тканей. В экспериментальном исследовании определены оптимальные параметры лазерного излучения с длиной волны 450 нм, применение которых может быть перспективно при дальнейшем использовании в клиническом исследовании для послойного удаления пигментных тканевых структур кожи путем сканирования.
ЗАКЛЮЧЕНИЕ
Экспериментально определены особенности «синего» лазерного излучения с длиной волны 450 нм для послойного и прогнозируемого удаления тканей пигментных образований кожного покрова с сохранением проксимальных участков придатков кожи, обеспечивающие удаление рассматриваемых образований на относительно большой площади при минимальном повреждении подлежащих тканей.
Для лечения различных пигментных структур кожи, включая ВГПН, экспериментально определены оптимальные режимы лазерного излучения с длиной волны 450 нм – мощностью 3,0 и 6,0 Вт с длительностью импульса 0,5 сек. и временем между импульсами 0,25 сек.
Лазерное излучение «синего» спектрального диапазона с длиной волны 450 нм перспективно для послойного удаления сканированием тканей пигментных образований кожи, включая ВГПН.
Список литературы
1. McCalmont, Timothy H. et al. “Perineuriomatous melanocytic nevi. Journal of cutaneous pathology; 2011; 38 (12): 940–2.
2. Червонная Л.В. Пигментные новообразования кожи. М.: ГЭОТАР-Медиа; 2016: 224 с.
3. Roh Mi Ryung, Eliades Philip, Gupta Sameer, Tsao Hensin. Genetics of melanocytic nevi. Pigment Cell & Melanoma Research. 2015; 28 (6): 661–672. DOI: 10.1111/pcmr.12412
4. Вулф К. Дерматология по Томасу Фицпатрику (атлас-справочник) издание 2-е. Москва. M.: Практика. 2007: 1248 c.
5. Krengel S., Scope A., Dusza S.W., Vonthein R., Marghoob A.A. New recommendations for the categorization of cutaneous features of congenital melanocytic nevi. J Am Acad Dermatol. 2013; (68): 441–451. DOI: 10.1016/j.jaad.2012.05.043
6. Дорошенко М.Б., Утяшев И.А., Демидов Л.В., Алиев М.Д. Клинические и биологические особенности гигантских врожденных невусов у детей. Педиатрия. Журнал им. Г.Н. Сперанского. 2016; (95–4): 50–56.
7. Arya Savita, Manali Jain, Motilal Bunkar and Rajendra Prasad Takhar. “Giant Congenital Melanocytic Nevus with Limb Hypoplasia and Lipomatosis: A Rare Association.” Journal of Pigmentary Disorders. 2016; (3): 1–3.
8. Schaffer J.V. Pigmented lesions in children: when to worry. Curr Opin Pediatr. 2007 Aug; 19(4): 430–40. DOI: 10.1097/MOP.0b013e32825b0788.
9. Ersen, B, Selçuk Akın, Ayse Sahin, Mehmet Can Şaki, Ismail Aksu, Orhan Tunalı, Furkan Karabulut and Suleyman Cecen. Clinical and histopathological analysis of 790 naevi excised from 509 patients due to cosmetic reasons. European Journal of Plastic Surgery. 2014; (38): 133–138.
10. Капустина О.Г. «Диагностика и оптимизация лечения новообразований кожи в амбулаторной практике дерматолога». 2009, 22 с.
11. Sommer L.L. et al. Persistent melanocytic nevi: a review and analysis of 205 cases. J. Cutan. Pathol. 2011; 38 (6): 503–507.
12. King Roy, Brett A Hayzen, Robert N. Page, Paul B Googe, Deborah Zeagler and Martin C. Jr. Mihm. Recurrent nevus phenomenon: a clinicopathologic study of 357 cases and histologic comparison with melanoma with regression. Modern Pathology 22 (2009): 611–617.
13. Данилин Н.А., Мариничева И.Г., Курдяев И.В. Современные методы лечения доброкачественных сосудистых и пигментных образований кожи. Пластическая хирургия и эстетическая медицина. 2023;3:130–137. DOI: 10.17116/plast.hirurgia2023031130
14. Данилин Н.А., Курдяев И.В. Применение углекислотного лазера в лечении доброкачественных новообразований кожи. Лазерная медицина. 2022; 26(1): 30–36. DOI: 10.37895/2071-8004-2022-26-1-30-36
15. Hong Kyung Tae, Jung Min Lim and Sang Eun Lee. A Treatment of Medium-to-Giant Congenital Melanocytic Nevi with Combined Er:YAG Laser and Long-Pulsed Alexandrite Laser. Med Laser. 2017; 6 (2):77–85. DOI: 10.25289/ML.2017.6.2.77
16. Цховребова Л.Э. Врожденные гигантские пигментные невусы у детей: клиника, диагностика, лечение. Детская хирургия. 2014; 18 (1): 38–41.
17. Гейниц А.В., Доронин В.А. Дермабразия СО2-лазером эпидермально-дермальных дефектов, а также увядающей кожи в амбулаторных условиях. М.: 2004: 92 с.
18. Скомаровский В.С., Дорофеева Т.Г. Технологии на основе световых, радиочастотных и плазменных воздействий в эстетической медицине. Альманах клинической медицины, 2008; (17–2): 184–185.
19. Nguyen Duy & Pang Jing-Yin & Madill, Catherine & Novakovic, Daniel. Effects of 445-nm Laser on Vessels of Chick Chorioallantoic Membrane with Implications to Microlaryngeal Laser Surgery. The Laryngoscope. 2021; 131(6): 1950–1956.
20. Дуванский В.А. Физические и физико-химические методы в комплексном лечении гнойных ран и трофических язв. Автореферат дис. … д-ра мед. наук. М. 2002. 30 с.
21. Astashov V.V., Kozlov V.I., Duvanskiy V.A., Novokreshchenov P.V., Pushkar I.M. The effect of photobiostimulation by light waves in the blue range of the spectrum on microcirculation parameters and the activity of oxidative homeostasis enzymes in the skin. Journal of biomedical photonics & engineering 2023; 9(1): 10309
Об авторах
С. А. ПодурарРоссия
Подурар Станислав Александрович – врач – детский хирург, аспирант
Москва
Н. Е. Горбатова
Россия
Горбатова Наталья Евгеньевна – кандидат медицинских наук, академик АМТН РФ, ведущий научный сотрудник
Москва
А. В. Брянцев
Россия
Брянцев Александр Владимирович – детский хирург, кандидат медицинских наук, директор
Москва
С. А. Золотов
Россия
Золотов Сергей Александрович – детский хирург, кандидат медицинских наук
Москва
В. А. Дуванский
Россия
Дуванский Владимир Анатольевич – доктор медицинских наук, профессор, заведующий кафедрой эндоскопии, эндоскопической и лазерной хирургии факультета непрерывного медицинского образования медицинского института
Москва
А. С. Тертычный
Россия
Тертычный Семенович Александр – доктор медицинских наук, профессор кафедры патологической анатомии им. академика А.И. Струкова
Москва
Г. А. Варев
Россия
Варев Геннадий Александрович – кандидат технических наук, генеральный директор
Тула
Рецензия
Для цитирования:
Подурар С.А., Горбатова Н.Е., Брянцев А.В., Золотов С.А., Дуванский В.А., Тертычный А.С., Варев Г.А. Экспериментальное исследование возможности использования «синего» (λ=50 нм) лазерного излучения для удаления пигментных образований. Лазерная медицина. 2023;27(3):21-35. https://doi.org/10.37895/2071-8004-2023-27-3-21-35
For citation:
Podurar S.A., Gorbatova N.Ye., Bryantsev A.V., Zolotov S.A., Duvanskiy V.A., Tertychny A.S., Varev G.A. An experimental study on the application of “blue” (λ = 450 nm) laser light to remove pigmented skin formations. Laser Medicine. 2023;27(3):21-35. (In Russ.) https://doi.org/10.37895/2071-8004-2023-27-3-21-35
JATS XML


























