Перейти к:
Результаты применения интраоперационной фотодинамической терапии при комбинированном лечении местнораспространенного рака толстой кишки
https://doi.org/10.37895/2071-8004-2023-27-2-8-15
Аннотация
Цель: изучение результатов комбинированного лечения местнораспространенного рака толстой кишки с применением интраоперационной фотодинамической терапии.
Материалы и методы. В исследование включено 35 пациентов с местнораспространенным раком толстой кишки. Основную группу составили 17 больных, которым в комплексе с плановым хирургическим лечением проводилась интраоперационная фотодинамическая терапия. В контрольную группу вошли 18 пациентов, которым проведено только хирургическое лечение. Для фотодинамической терапии применялся фотосенсибилизатор фотолон и диодный лазер «Лахта-Милон» с длиной волны 662 нм и мощностью до 2,5 Вт. Доставка излучения проводилась посредством кварцполимерного световода диаметром 600 мкм.
Результаты и обсуждение. В основной группе наблюдались более положительные ближайшие и отдаленные результаты лечения пациентов местнораспространенным раком толстой кишки по сравнению с контрольной группой (длительность госпитализации, количество ремиссий, рецидивов и летальности).
Заключение. Интраоперационная фотодинамическая терапия улучшает результаты комбинированного лечения пациентов с местно-распространенным раком толстой кишки.
Ключевые слова
Для цитирования:
Крочек И.В., Ибатуллин Р.Д., Лаппа А.В., Анчугова А.Е. Результаты применения интраоперационной фотодинамической терапии при комбинированном лечении местнораспространенного рака толстой кишки. Лазерная медицина. 2023;27(2):8-15. https://doi.org/10.37895/2071-8004-2023-27-2-8-15
For citation:
Krochek I.V., Ibatullin R.D., Lappa A.V., Anchugova A.E. Outcomes after intraoperative photodynamic therapy in the combined treatment of locally advanced colon cancer. Laser Medicine. 2023;27(2):8-15. (In Russ.) https://doi.org/10.37895/2071-8004-2023-27-2-8-15
ВВЕДЕНИЕ
По данным аналитического отчета МНИОИ им. П. А. Герцена, колоректальный рак находится на третьем месте по распространенности онкологических заболеваний в России. Для его лечения наиболее часто (в 64,9 % случаев – для опухолей ободочной кишки и в 44,7 % – для опухолей ректосигмоидного отдела и прямой кишки) используют исключительно хирургический метод, но иногда удаление первичной опухоли и метастатических очагов недостаточно вследствие прогрессирования опухолевого процесса [1]. По данным исследований во время операции у 12–30 % больных раком толстой кишки обнаруживают местное распространение опухоли [2][3].
Для снижения риска местного рецидива и перитонеального канцероматоза применяют комбинированные способы лечения, сочетающие хирургический метод с дополнительными противоопухолевыми методами воздействия на область операционного поля. Одним из таких дополнительных методов является фотодинамическая терапия (ФДТ). Описаны единичные клинические случаи применения ФДТ в лечении колоректального рака, рандомизированные контролируемые исследования не проводились [4–10]. Анализ исследований в соответствии с протоколом PRISMA выполнен в систематическом обзоре, недавно зарегистрированном в международном реестре [11]. Его авторы ставили целью выявить наиболее успешные схемы лечения, но столкнулись с большой вариативностью представленных в работах параметров лечения. Анализируемые исследования, среди которых была и наша работа [10], отличаются типом и дозой использованного фотосенсибилизатора (ФС), контролем его накопления в тканях (фотодинамическая диагностика – ФДД), длиной волны и световой дозой лазерного излучения, способом его доставки к опухоли. Сообщается об эффективности применения ФДТ в лечении колоректального рака как в качестве самостоятельного метода для неоперабельных больных [4][8][9], так и в сочетании с хирургическим лечением [5][10]. Недостаточный объем исследований и неоднородность параметров лечения не позволяют сделать выводов по поводу оптимальных схем лечения. Особенно это касается выбора ФС. Наиболее распространенные в России фотосенсибилизаторы хлоринового ряда в данном исследовании не представлены, за исключением радахлорина [10], а фотолон, используемый в настоящей работе, ранее не применялся.
Цель исследования: изучение результатов комбинированного лечения местнораспространенного рака толстой кишки с применением интраоперационной фотодинамической терапии.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось в онкологическом отделении ГКБ № 1 г. Челябинска в период с 2017 по 2021 год. 35 пациентов с местнораспространенным раком толстой кишки были разделены на две сопоставимые группы. Основную группу составили 17 больных (8 мужчин и 9 женщин), которым в комплексе с плановым хирургическим лечением проводилась интраоперационная ФДТ. В контрольную группу вошли 18 пациентов (7 мужчин, 11 женщин), находившихся на лечении в 2015–2016 годах, которым интраоперационная ФДТ не проводилась.
Всем пациентам обеих групп проведены клинические, эндоскопические, рентгенологические исследования кишечника, УЗИ, МРТ или КТ для оценки распространенности процесса. У всех пациентов опухолевые процессы были морфологически верифицированы. Выполнялись также, по показаниям, фиброгастродуоденоскопия, экскреторная урография с нисходящей цистографией, цистоскопия, осмотр гинеколога и уролога с целью определения характера местного распространения опухоли.
В структуре операций, выполненных пациентам обеих групп, радикальные вмешательства составили: в основной группе – 76,5 % (13 пациентов), контрольной – 72,2 % (13 пациентов), остальным пациентам произведены условно-радикальные операции. В основной группе проводились комбинированные резекции толстой кишки с резекцией смежных структур, вовлеченных в опухолевый процесс: право- и левосторонние гемиколэктомии, резекции поперечно-ободочной кишки с лимфодиссекцией D2, брюшнопромежностные экстирпации прямой кишки с лимфодиссекцией D2. Показанием к выполнению комбинированных операций при местнораспространенных формах рака толстого кишечника считалось врастание опухоли в соседние структуры при резектабельности процесса и отсутствии отдаленных метастазов. После операций у 10 пациентов (4 – в основной и 6 – в контрольной группах) выведены разгрузочные колостомы. Причинами это явились возможность нарушения кровоснабжения стенки кишки при хронической кишечной непроходимости и дистальное расположение опухоли прямой кишки.
После резекций в рамках основного этапа ФДТ производилось облучение ложа опухоли и под резецированными тканями. В контрольной группе выполнялся такой же объем оперативного вмешательства, за исключением ФДТ. Для обезболивания использовалась комбинированная анестезия. После операций всем пациентам обеих групп проведены полностью идентичные схемы лечения АПХТ FOLFOX6, FOLFIRI.
Распределение пациентов обеих групп по полу и возрасту, стадиям и локализации опухолей, вовлечению в онкологический процесс соседних органов, на которых проведены операции резекции, представлено в таблицах 1–4.
Таблица 1
Распределение пациентов по полу и возрасту
Table 1
Distribution of patients by gender and age
Показатели Indicators | Основная группа Main group | Контрольная группа Control group |
Пол: мужчины/женщины Sex: men/women | 8/9 | 7/11 |
Возраст, лет Age, years | ||
40–49 | 1 (5,8 %) | 2 (11,1 %) |
50–59 | 2 (11,6 %) | 2 (11,1 %) |
60–69 | 7 (41,2 %) | 8 (44,4 %) |
70–79 | 5 (29,4 %) | 5 (27,7 %) |
Старше 80 Older than 80 | 2 (11,6 %) | 1 (5,6 %) |
Таблица 2
Стадии онкологического заболевания
Table 2
Stages of cancer disease
Стадии Stages | Основная группа Main group | Контрольная группа Control group |
II стадия (T3–4N0M0) Stage II (T3–4N0M0) | 2 (11,8 %) | 2 (11,1 %) |
III стадия (T4N2M0) Stage III (T4N2M0) | 11 (64,7 %) | 13 (72,2 %) |
IV стадия (T1–4N1–2M1–2) Stage IV (T1–4N1–2M1–2) | 4 (23,5 %) | 3 (16,7 %) |
Таблица 3
Локализация онкологического заболевания
Table 3
Cancer location
Отделы толстой кишки Colon | Основная группа Main group | Контрольная группа Control group |
Слепая кишка Cecum | 1 (5,9 %) | 2 (11,1 %) |
Восходящая кишка Ascending colon | 2 (11,8 %) | 1 (5,6 %) |
Печеночный изгиб Hepatic flexure | 2 (11,8 %) | 1 (5,6 %) |
Селезеночный изгиб Splenic flexure | 1 (5,9 %) | 2 (11,1 %) |
Нисходящая кишка Descending colon | 1 (5,9 %) | 2 (11,1 %) |
Сигмовидная кишка Sigmoid colon | 4 (23,5 %) | 4 (22,2 %) |
Ректосигмоидный отдел Rectosigmoid colon | 3 (17,6 %) | 3 (16,7 %) |
Прямая кишка Rectum | 3 (17,6 %) | 3 (16,7 %) |
Таблица 4
Резецированные близлежащие органы, пораженные опухолевым процессом
Table 4
Resected nearby organs affected by tumor process
Органы Organs | Основная группа Main group | Контрольная группа Control group |
Мочевой пузырь, простата Bladder, prostate | 4 (23,5 %) | 3 (16,6 %) |
Матка и шейка матки Uterus and cervix | 2 (11,8 %) | 1 (5,6 %) |
Придатки матки Uterine appendages | 2 (11,8 %) | 3 (16,6 %) |
Простата Prostate | 1 (5,9 %) | 1 (5,6 %) |
Передняя брюшная стенка Anterior abdominal wall | 2 (11,8 %) | 2 (11,1 %) |
Почка, забрюшинное пространство Kidney, retroperitoneal space | 1 (5,9 %) | 2 (11,1 %) |
Петли тонкого кишечника Small intestine loops | 4 (23,5 %) | 5 (27,7 %) |
Левая доля печени Liver left lobe | 1 (5,9 %) | 1 (5,6 %) |
Таким образом, у больных основной и контрольной групп в распределении по полу, возрасту, стадиям и локализации опухолей, объему хирургического лечения значимых различий не было. Пациенты также были сопоставимы по морфологической оценке опухолей: чаще наблюдались умеренно дифференцированные и высокодифференцированные аденокарциномы (52,9 % – в основной и 61,1 – в контрольной группах), реже – низкодифференцированные и недифференцированные (47,1 % – в основной и 38,9 – в контрольной группах).
ФДТ проводилась пациентам основной группы и включала введение фотосенсибилизатора (ФС), лазерное облучение и ФДД (измерение уровня накопления ФС в тканях). Использовался фотолон – ФС второго поколения хлоринового ряда, имеющий высокий пик в спектре поглощения с максимумом при длине волны около 662 нм. Применялся диодный лазер «Лахта-Милон» («ООО Милон-лазер»), с длиной волны 662 нм, мощностью – до 2,5 Вт. Доставка излучения проводилась посредством кварцполимерного световода диаметром 600 мкм.
Для ФДД применялся абсорбционный метод по отражательно-зондовой схеме, при котором используются изменения в спектре диффузного отражения ткани, вызываемые накоплением в ней ФС. Пик поглощения ФС вызывает провал в спектре отражения, по которому определяется уровень накопления ФС. Метод применен с помощью разработанной нами установки, включающей светодиодный термостабилизированный источник белого света, CCD-спектрометр «Avantes», компьютер с управляющей и обрабатывающей программами, созданными нами с использованием динамической библиотеки функций, предоставленной производителем спектрометра (рис. 1 а) и оптоволоконный зонд диаметром 3,4 мм, в торце которого расположены пять кварцполимерных световодов диаметром 600 мкм: по четырем свет от источника поступает в исследуемый объект, по пятому, отстоящему от них на 1,5 мм – отводится от него на спектрометр (рис. 1 б).

Рис. 1. Схема установки для ФДД (а) и оптоволоконный зонд (б)
Fig. 1. Scheme of the complex for photodynamic diagnostics (PDD) (a)
and optic fiber (b)
Непосредственно измеряемый приборный спектр сильно отличается от нужного спектра диффузного отражения света в данной геометрии (в детектирующем волокне от осветительных) из-за спектральных зависимостей излучения источника, проницаемости волокон и чувствительности спектрометра. Как результат, «провал» ФС в приборном спектре почти не виден. Но он проявляется в отношении приборных спектров от исследуемой ткани и от некоторого несенсибилизированного отражателя (референса), поскольку в таком отношении указанные зависимости сокращаются и остается чистый относительный спектр диффузного отражения. Максимально четко «провал» проявляется, если в качестве референса взять исследуемую ткань до введения ФС. В нашем случае такой идеальный референс недоступен, и мы используем универсальные референсы, в частности почти непоглощающий водный раствор интралипида, имеющий достаточно однородный спектр отражения. При таких референсах для применимости метода (проявления «провала») дополнительно необходимо, чтобы пик поглощения ФС был достаточно узким на фоне спектра поглощения ткани. Это выполняется при применении хлориновых ФС, включая фотолон, что иллюстрируют относительные спектры с концентрациями фотолона, измеренные в процессе ФДД одного из пациентов основной группы. Визуализируются «провалы» на месте пика поглощения ФС и положительная корреляция их глубины и концентрации ФС. В качестве количественной меры глубины – ФС-сигнала приняли величину
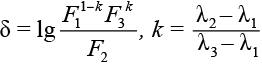 ,
,
где λi – длины волн, Fi – относительные спектры отражения на них. λ2 соответствует максимуму пика поглощения ФС (662 нм), λ1, λ3 – границе существенного диапазона пика (эмпирические параметры метода). В ФДД с фотолоном принимали λ1= 642 нм, λ3= 684 нм (k = 0,476). В экспериментах на фантомах показано, что эти параметры обеспечивают прямую пропорциональность ФС-сигнала δ от концентрации ФС при всех наблюдаемых в клинике концентрациях, при этом коэффициент пропорциональности слабо зависит от типа ткани. Поэтому отношение ФС-сигналов для разных тканей близко к отношению концентраций ФС в них, что принято как соответствующая контрастность накопления (рис. 2).
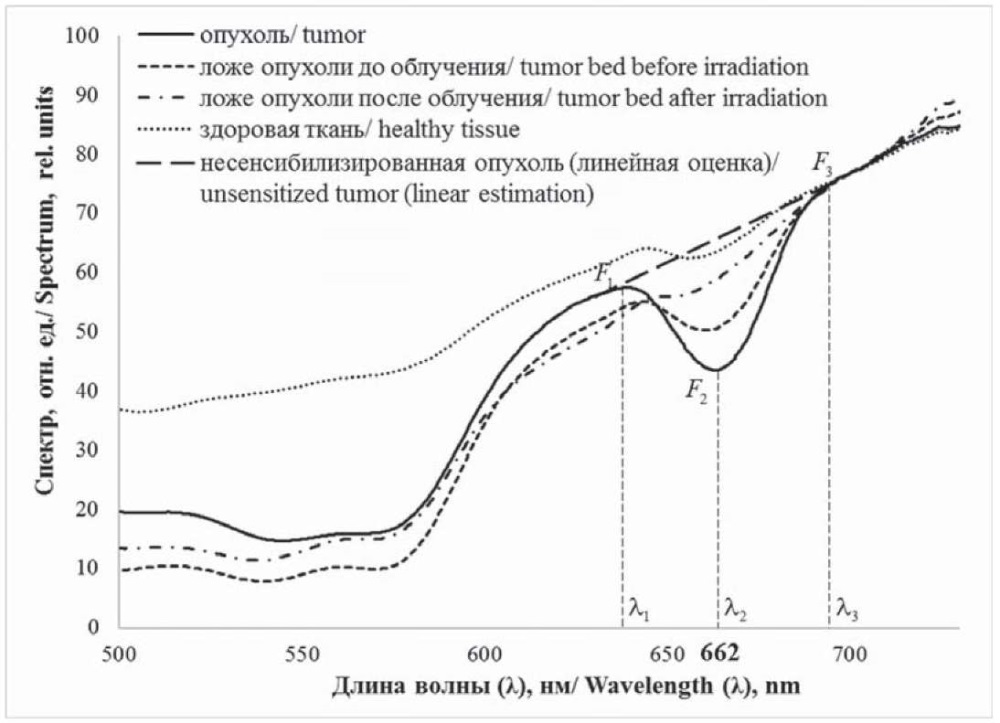
Рис. 2. Относительный спектр отражения сенсибилизированных тканей
с интралипидным референсом у пациента основной группы
Fig. 2. Relative reflection spectrum of sensitized tissues
with intralipid reference in a patient from the main group
Фотосенсибилизатор фотолон применяли в дозе 1,0–1,2 мг/кг массы тела больного, препарат растворяли в 200 мл 0,9 % раствора натрия хлорида и вводили внутривенно капельно в течение 30 мин за 1 час до начала операции. Через 2–5 ч после введения ФС и проведения основного хирургического этапа проводился сеанс поверхностного лазерного облучения ложа опухоли вместе с зоной пораженных соседних органов, а также путей возможного метастазирования, в суммарной световой дозе 50–200 Дж/см². Длительность процедуры составляла 15–35 минут. Разброс перечисленных параметров был обусловлен различными размерами опухолевого очага, особенностями операции и организационными моментами.
ФДД проводилось на трех этапах операции: 1-й – после достижения доступа к опухоли и региональным лимфатическим узлам (до их удаления), 2-й – сразу после их удаления, 3-й – после облучения. В первом случае измерения проводились в центре опухоли, в лимфоузлах I и II порядка, в окружении опухоли (2–3 см от края) и на здоровом участке стенки толстой кишки. Второе и третье измерения проводились в ложе опухоли, удаленных лимфоузлах и окружающей ткани.
Статистическая обработка результатов проводилась с помощью программ «Microsoft Exсel 2010» и «StatSoft Statistica 10». Достоверность различий цифровых данных в группах определяли методом Стьюдента. Статистический показатель считали значимым при p < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Применение ФДД позволило выработать тактику облучения различных тканей во время ФДТ. На рисунке 3 представлены значения контрастности накопления ФС относительно здоровой ткани в центре и ложе опухоли после ее удаления, в окружающих тканях и лимфатических узлах. Видно, что в большинстве случаев уровень накопления ФС в ложе опухоли меньше, чем в самой опухоли до удаления, но больше по сравнению со здоровыми тканями, что может свидетельствовать о сохранении остаточных очагов раковых клеток в ложе опухоли и подтверждает правильность выбранной методики лечения. Профилактический сеанс облучения проводился и в тех отдельных случаях, когда накопление ФС в ложе опухоли было на уровне здоровых тканей. Зона окружения опухоли имела повышенную контрастность накопления ФС, что может указывать на вовлечение данных тканей в онкологический процесс и требует их облучения во время ФДТ. Среди лимфатических узлов удалению подлежали те, которые имели накопление ФС выше уровня здоровой ткани и те, которые не имели накопления ФС, но соотносились с общепринятыми объемами лимфодиссекции D2. Уменьшение контрастности накопления ФС после ФДТ, наблюдаемое во всех облученных тканях, связано с «выгоранием» (эффект фотобличинга) ФС, сопровождающим фотодинамическую реакцию.
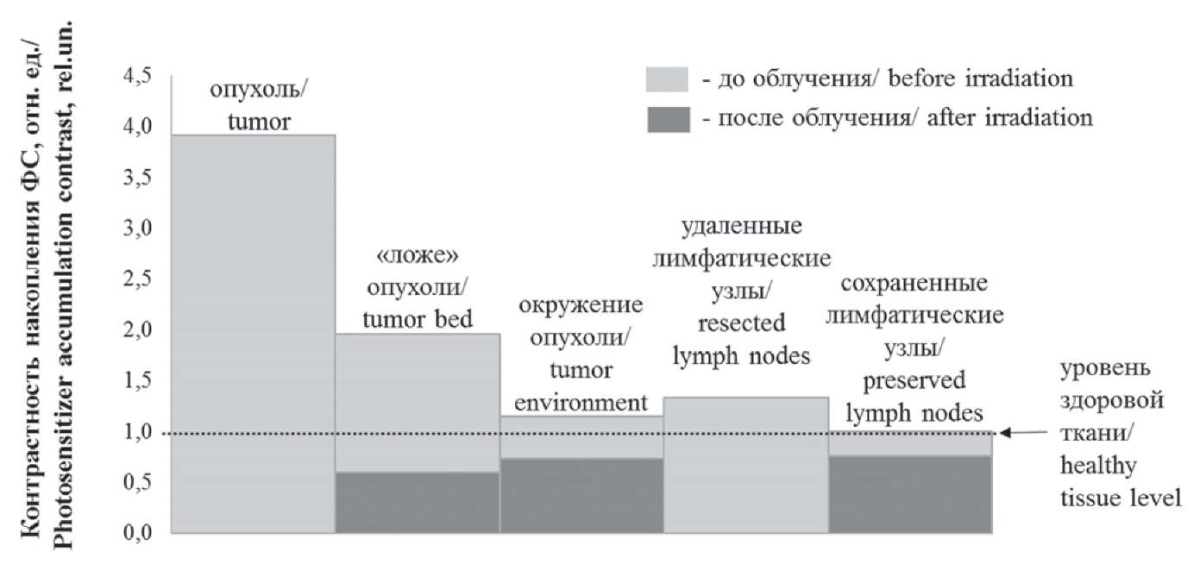
Рис. 3. Средние значения контрастности накопления
фотосенсибилизатора в различных тканях
Fig. 3. Average values of contrast accumulation
of photosensitizer in various tissues
Ближайшие и отдаленные (42 месяца наблюдения) результаты лечения пациентов с местнораспространенным раком толстой кишки представлены в таблицах 5 и 6.
Таблица 5
Ближайшие результаты лечения
Table 5
Immediate results of treatment
Показатели Indicators | Основная группа Main group | Контрольная группа Control group |
Длительность операции (часы) Surgery duration (hours) | 3,2 ± 1,7 | 2,4 ± 0,5 |
Уровень боли по визуально-аналоговой шкале (баллы) Pain level at visual-analog scale (VAS) (points) | 2,1 ± 0,6 | 3,5 ± 1,3 |
Восстановление перистальтики желудочно-кишечного тракта (сутки) Restoration of gastrointestinal peristalsis (days) | 1,8 ± 1,1 | 2,2 ± 1,2 |
Длительность отделяемого по дренажам (сутки) Duration of discharge leakage through drains (days) | 2,5 ± 1,4 | 3,3 ± 1,6 |
Период гипертермии (сутки) Hyperthermia period (days) | 3,2 ± 1,6 | 4,1 ± 1,4 |
Длительность госпитализации (сутки) Length of hospital stay (days) | 14,1 ± 1,5 | 16,4 ± 2,3 |
Достоверность Reliability | p < 0,05 | p < 0,05 |
Таблица 6
Отдаленные результаты лечения
Table 6
Long-term results of treatment
Показатели Indicators | Основная группа Main group | Контрольная группа Control group |
Ремиссия Remission | 12 (70,6 %)* | 7 (38,9 %) |
Рецидив Relapse | 5 (29,4 %)* | 11 (61,1 %) |
Смерть Death | 3 (17,6 %) | 4 (22,2 %) |
Примечание: * – достоверное различие с контрольной группой: p < 0,05.
Note: * – significant difference with the control group: p < 0.05.
Несмотря на небольшое количество наблюдений и отсутствие достоверных различий между группами по некоторым показателям, можно сделать предварительные выводы о том, что результаты в основной группе были лучше, чем в контрольной (длительность госпитализации, количество ремиссий, рецидивов и летальности).
Различия в схемах лечения, отсутствие единых критериев оценки эффективности терапии не позволяют провести корректное сравнение полученных результатов с данными литературы. Имеется публикация, указывающая на уменьшение длительности госпитализации, клинических симптомов и послеоперационных осложнений у пациентов после химиотерапии и ФДТ, в которой полученные результаты авторы не анализируют [8]. Возможно, это связано с воздействием низкоинтенсивного лазерного облучения (эффект фотобиостимуляции), сопровождающей ФДТ. Об этом свидетельствуют результаты применения ФДТ в стоматологии с целью уменьшения послеоперационной боли и воспаления, что объясняется фотобиостимуляционным и антимикробным эффектами [12][13].
ЗАКЛЮЧЕНИЕ
Интраоперационная фотодинамическая терапия улучшает результаты комбинированного лечения пациентов местнораспространенным раком толстой кишки.
Список литературы
1. Каприн А.Д., Старинский В.В., Шахзадова А.О. Состояние онкологической помощи населению России в 2021 году. М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России. 2022, 239.
2. Хватов А.А., Майстренко Н.А., Сазонов А.А., Шерстнова Е.М., Оточкин В.В. Возможности хирургического лечения пациентов с рецидивами рака прямой кишки. Вестник хирургии. 2018; 177; 2: 39–45.
3. Ачкасов С.И., Назаров И.В., Сушков О.И., Лихтер М.С. Местный рецидив рака ободочной кишки: результаты лечения. Хирургия. 2019; 3: 21–31.
4. Barr H, Krasner N., Boulos P.B. Photodynamic therapy for colorectal cancer: a quantitative pilot study. Br J Surg. 1990; 77 (1): 93–96.
5. Stranadko E.P., Skobelkin O.K., Vorozhtsov G.N. Photodynamic therapy of cancer: five-year clinical experience. Proc. SPIE 3191. Photochemotherapy: Photodynamic Therapy and Other Modalities III. 1997. DOI: 10.1117/12.297812
6. Nakamura M., Nishikawa J., Hamabe K. Preliminary study of photodynamic diagnosis using 5-aminolevulinic acid in gastric and colorectal tumors. World J. Gastroenterol. 2015; 21: 6706–6712. DOI: 10.3748/wjg.v21.i21.6706
7. Kawczyk-Krupka A., Bugaj A.M., Latos W. Photodynamic therapy in colorectal cancer treatment – The state of the art in preclinical research. Photodiagnosis and Photodynamic Therapy. 2016; 13: 158–174. DOI: 10.1016/j.pdpdt.2015.07.175
8. Sun B.O., Li W., Liu N. Curative effect of the recent photofrin photodynamic adjuvant treatment on young patients with advanced colorectal cancer. Oncol. Lett. 2016; 11: 2071–2074. DOI: 10.3892/ol.2016.4179
9. Zhang S.Q., Liu K.J., Yao H.L. Photodynamic therapy as salvage therapy for residual microscopic cancer after ultralow anterior resection: A case report. World J Clin Cases. 2019; (7) 6: 798–804.
10. Privalov V., Lappa A., Seliverstov O. Clinical Trials of a New Chlorin Photosensitizer for Photodynamic Therapy of Malignant Tumors. Proc. SPIE. 4612. 2002.
11. Guidolin K., Ding L., Yan H. Photodynamic Therapy for Colorectal Cancer: A Systematic Review of Clinical Research. Surgical Innovation. 2022; 29 (6): 788–803. DOI: 10.1177/15533506221083545 (PROSPERO, CRD42021233971)
12. Alves-Silva E.G., Arruda-Vasconcelos R., Louzada L.V. The effect of photodynamic therapy on postoperative pain in teeth with primary endodontic infection. Photodiagnosis and Photodynamic Therapy. 2022; 37: 102–107.
13. Coelho M.S., Vilas-Boas L., Tawil P.Z. The effects of photodynamic therapy on postoperative pain in teeth with necrotic pulps. Photodiagnosis and Photodynamic Therapy. 2019; 27: 396–401.
Об авторах
И. В. КрочекРоссия
Игорь Викторович Крочек, доктор медицинских наук, профессор
кафедра общей и детской хирургии
Челябинск
Р. Д. Ибатуллин
Россия
Роберт Дамирович Ибатуллин, заведующий отделением
онкологическое отделение
Челябинск
А. В. Лаппа
Россия
Александр Владимирович Лаппа, доктор физико-математических наук,
профессор
кафедра общей и теоретической физики
Челябинск
А. Е. Анчугова
Россия
Анастасия Евгеньевна Анчугова, физик, старший преподаватель
НОЦ «Проблемы фундаментальной медицины»
кафедра общей и теоретической физики
Челябинск
Рецензия
Для цитирования:
Крочек И.В., Ибатуллин Р.Д., Лаппа А.В., Анчугова А.Е. Результаты применения интраоперационной фотодинамической терапии при комбинированном лечении местнораспространенного рака толстой кишки. Лазерная медицина. 2023;27(2):8-15. https://doi.org/10.37895/2071-8004-2023-27-2-8-15
For citation:
Krochek I.V., Ibatullin R.D., Lappa A.V., Anchugova A.E. Outcomes after intraoperative photodynamic therapy in the combined treatment of locally advanced colon cancer. Laser Medicine. 2023;27(2):8-15. (In Russ.) https://doi.org/10.37895/2071-8004-2023-27-2-8-15



























