Перейти к:
Применение углекислотного лазера в лечении доброкачественных новообразований кожи
https://doi.org/10.37895/2071-8004-2022-26-1-30-36
Аннотация
Цель исследования: оценка результатов лечения доброкачественных новообразований кожи с применением углекислотного лазера.
Материалы и методы. Проведен анализ результатов лечения 1394 пациентов доброкачественными новообразованиями кожи. В основной группе (1184 больных) применяли методики лазерной фотокоагуляции (вапоризации) и лазерной фотогидравлической препаровки. Использовали лазерные хирургические установки «Ланцет-1» и «Ланцет-2» мощностью до 20 Вт, диаметром сфокусированного пучка до 1 мм, работающие в непрерывном и импульсном режиме. В контрольной группе (210 больных) применяли традиционные методы лечения (иссечение и электрокоагуляция).
Результаты. Подтверждена высокая эффективность применения углекислотного лазера при удалении доброкачественных новообразований кожи, связанная с минимальным количеством осложнений и рецидивов, а также с удовлетворительным эстетическим результатом терапии, по сравнению с традиционным лечением.
Заключение. Применение углекислотного лазера в лечении доброкачественных новообразований кожи является высокоэффективным методом.
Ключевые слова
Для цитирования:
Данилин Н.А., Курдяев И.В. Применение углекислотного лазера в лечении доброкачественных новообразований кожи. Лазерная медицина. 2022;26(1):30-36. https://doi.org/10.37895/2071-8004-2022-26-1-30-36
For citation:
Danilin N.A., Kurdyaev I.V. Carbon dioxide laser in the treatment of benign skin neoplasms. Laser Medicine. 2022;26(1):30-36. (In Russ.) https://doi.org/10.37895/2071-8004-2022-26-1-30-36
ВВЕДЕНИЕ
Доброкачественные новообразования кожи являются распространенными. По данным литературы, частота заболеваемости ими в 3–4 раза выше, чем злокачественными [1–4].
Новообразования кожи по клиническому течению делятся на злокачественные, доброкачественные и предраковые [5]. Существует несколько способов лечения опухолей кожи [6][7]. Описание этих методов и их эффективности – тема отдельного всестороннего исследования. Наша задача, в рамках данной работы, – показать возможный путь усовершенствования хирургического метода в аспекте пластической хирургии и косметологии.
Традиционный хирургический метод лечения не потерял своего значения. Обычное иссечение скальпелем обладает тем преимуществом, что опухоль можно удалить за один сеанс, но требует дополнительных мероприятий, направленных на достижение приемлемого уровня гемостаза, при этом в тканях могут остаться опухолевые клетки, способные стать потенциальным источником рецидивов.
Электрохирургический метод, также считающийся традиционным, позволяет быстро удалить новообразование с незначительным кровотечением.
Недостаток метода состоит в том, что на фоне термической травмы окружающих тканей имеется большая вероятность образования грубого рубца; кроме того, процесс рубцевания и эпителизации операционной раны может потребовать более длительного времени [7].
Ни один из существующих на сегодняшний день методов диссекции тканей не может полностью удовлетворить хирургов и вызывает необходимость поиска новых путей решения указанной проблемы. На современном этапе развития эстетической хирургии востребована возможность удалять доброкачественные опухоли кожи, не оставляя грубых, иногда даже и заметных послеоперационных рубцов [8–11]. Именно с этой точки зрения правильный выбор методики операции во многом имеет решающие значение.
Несомненный интерес в этой связи представляет использование излучения высокоэнергетических лазеров. И это вполне обосновано, так как применение лазерного излучения на биологические структуры имеет специфическое, отличное от всех других известных видов воздействие. В основе лежат физические свойства самого лазерного луча, а также физико-биологические свойства кожи и подлежащих тканей. К физическим факторам лазерного излучения относятся: мощность энергии, длина волны излучения, монохроматичность, поляризация, когерентность, режим работы лазера, время воздействия. К физико-биологическим свойствам кожи относятся: отражающая и поглощающая способность, теплопроводность, теплоемкость, степень пигментации и васкуляризации [12–14].
В зависимости от выбранного вида лазерного излучения можно бескровно рассекать биологические ткани, обеспечивая оптимальные условия асептики и абластичности, испарять и коагулировать патологические образования, стимулировать репаративные процессы, что в итоге позволяет достигать наилучших косметических и функциональных результатов [11][15][16].
В связи с модернизацией лазерной техники и появлением новых типов лазерного излучения усовершенствуются и методы хирургических вмешательств [8][17][18]. Наиболее широкое распространение в хирургии нашли углекислотные лазеры.
МАТЕРИАЛЫ И МЕТОДЫ
В стационаре и в поликлиническом отделении лазерной пластической хирургии за последние 5 лет было проведено удаление доброкачественных опухолей кожи различной локализации у 1394 пациентов, из них 26,7 % составили мужчины и 73,3 % – женщины. Возраст обратившихся за помощью варьировал от 20 до 82 лет. Среди новообразований, подлежавших лечению, имели место три нозологические формы: папилломы, кератомы и фибромы. Все пациенты по методике лечения разделены на две группы. В основную группу вошли 1184 пациента, у которых использовали излучение CO2-лазера. Вторая (контрольная) группа состояла из 210 человек, в их лечении применяли традиционные хирургические методы с помощью скальпеля или электрохирургического инструмента. Общая характеристика пациентов по нозологическим формам и полу отражена в таблице 1.
Таблица 1
Количественное распределение пациентов по нозологическим формам, полу и возрасту
Table 1
Quantitative distribution of patients by nosological forms, gender and age
Нозология Nosology | Основная группа Main group | Контрольная группа Control group | ||
Мужчины Men | Женщины Women | Мужчины Men | Women Женщины | |
Папилломы | 173 | 468 | 34 | 58 |
Кератомы | 109 | 327 | 21 | 65 |
Фибромы | 23 | 84 | 12 | 20 |
Всего | 305 | 879 | 67 | 143 |
ИТОГО | 1184 | 210 | ||
Выбор нозологических форм обусловлен преобладающей частотой обращения к специалистам отделения пластической хирургии пациентов с указанными новообразованиями.
Пациенты обеих групп проходили стандартную процедуру осмотра и обследования, включающую в себя дерматоскопию и консультацию онколога (по показаниям). В качестве основных базовых признаков доброкачественных образований фиксировали: неизмененную структуру окружающей кожи, медленный рост опухоли, отсутствие воспаления, боли, кровотечения или изъязвления. Для операции выбирали одну анатомическую область (лицо, туловище, верхние или нижние конечности), где удалялось от 1 до 12 новообразований.
Период наблюдения составлял от 3 месяцев до одного года. В качестве критериев сравнения двух групп служили: выраженность болевого синдрома после операции, время заживления ран, наличие рецидивов опухоли, качество рубца и эстетическая удовлетворенность результатом. Применяемые хирургические вмешательства по объему не несли угрозы функциональных нарушений, поэтому этот критерий не учитывался в оценках.
Рецидив опухоли, патологический характер рубцевания, а также срок закрытия ран определяли при контрольных осмотрах. Эстетическая удовлетворенность пациентов результатом лечения выяснялась в процессе итоговых опросов без анкетирования. Интенсивность болезненных ощущений после операции оценивали по международной визуально-аналоговой шкале боли [19].
В своей работе мы пользовались высокоэнергетическими углекислотными лазерными хирургическими аппаратами «Ланцет-1» и «Ланцет-2», которые при идентичных характеристиках отличаются друг от друга вертикальным либо горизонтальным вариантом компоновки (рис. 1). Вертикальная конструкция аппарата «Ланцет-2» увеличивает радиус работы манипулятора и требует меньше места в ограниченном пространстве операционной.

Рис. 1. Лазерные хирургические аппараты «Ланцет-1» и «Ланцет-2»
Fig. 1. Laser surgical devices “Lancet-1” and “Lancet-2”
Оба представленных аппарата позволяют работать в непрерывном и импульсном режимах излучения высокоэнергетического углекислотного лазера, имеют сенсорную панель управления и плавную ступенчатую регулировку мощности с шагом 0,1 Вт в диапазоне от 0,5 до 20 Вт. В наконечник манипулятора вмонтирована оптическая система, обеспечивающая фокусировку лазерного излучения. Предусмотрена возможность ступенчатого изменения размера светового пятна в точке фокусировки: 0,2, 0,3 и 0,5 мм. Это позволяет менять плотность мощности лазерного излучения в точке фокусировки и ширину разреза биологических тканей. Наведение невидимого излучения у глекислотного лазера на биообъект осуществляется с помощью диодного пилот-лазера мощностью 2 мВт.
В зависимости от распространенности, локализации патологического очага в основной группе выполнялось два вида оперативных вмешательств с использованием углекислотного лазера:
- Лазерная фотокоагуляция (вапоризация).
- Лазерная фотогидравлическая препаровка опухоли с ушиванием краев раны или различными вариантами пластики мягкими тканями.
В контрольной группе аналогичные цели достигались с помощью электрохирургического инструмента или скальпеля, используемых при следующих операциях:
- Электрокоагуляция.
- Иссечение опухоли скальпелем с различными вариантами закрытия раневого дефекта.
Соотношение количества пациентов по группам, по локализации опухолей и по видам хирургического лечения показано в таблице 2.
Таблица 2
Соотношение количества пациентов по группам, локализации опухолей и видам хирургического лечения
Table 2
Ratio of number of patients by group, tumor localization and types of surgical treatment
Локализация опухоли Tumor localization | Вид хирургического лечения Types of surgical treatment | |||||
Основная группа Main group | Контрольная группа Control group | |||||
Лазерная фотокоагуляция (вапоризация) Laser photocoagulation (vaporization) | Лазерная фотогидравлическая препаровка Laser photohydraulic dissection | Всего Total | Иссечение опухоли скальпелем Tumor scalpel dissection | Электрокоагуляция Electrocoagulation | Всего Total | |
Лицо и шея | 369 | 29 | 398 | 6 | 39 | 45 |
Туловище | 396 | 85 | 481 | 23 | 72 | 95 |
Верхние конечности | 149 | 26 | 175 | 9 | 25 | 34 |
Нижние конечности | 89 | 41 | 130 | 19 | 17 | 36 |
Всего | 1003 | 181 | 1184 | 57 | 153 | 210 |
Лазерная фотокоагуляция
Показанием к данному виду лечения являются опухоли диаметром до 1 см, если они локализуются на лице или шее, а также опухоли диаметром не более 2,5 см на других участках тела. Лазерная фотокоагуляция показана при расположении доброкачественных опухолей на нижнем или верхнем крае крыла носа, на кончике носа, на кожной части входа в полость носа, на внутренних поверхностях ушных раковин, в области верхних и нижних век, в области анального прохода, а также на участках, которые труднодоступны для операции с применением обычного скальпеля, которая может привести к деформации органа или к плохому косметическому результату.
Техника операции заключалась в следующем. Максимально инфильтрировали 0,25–0,5%-ным раствором лидокаина или новокаина саму опухоль и подлежащие ткани. Это необходимо не только с целью анестезии, но и для создания защитного жидкостного барьера, предохраняющего окружающие ткани от температурного воздействия лазерного луча. Вапоризацию (испарение) опухоли начинали с ее периферии, захватывая при этом ободок здоровой ткани до 1 мм, и постепенно перемещались к центру (рис. 2). В работе использовали от 20 до 60 % мощности установки, плотность мощности составляет от 0,009 до 0,027 кВт/мм2. Вариабельность лазерного излучения зависела от локализации опухоли, так как толщина кожного покрова на различных участках тела неодинакова. Для оценки этой особенностей кожи использовали таблицу К.А. Калантаевской [20], и на ее основе определяли необходимую мощность лазерного излучения. В своей работе мы убедились, что увеличение мощности более 20 Вт при испарении нежелательна, так как трудно контролировать глубину проникновения лазерного луча, и зона коагуляционного некроза увеличивается, что может неблагоприятно отразиться на косметическом результате. Вапоризацию доброкачественных новообразований, во избежание рецидива, осуществляли до исчезновения в ране обугленных участков, образующихся при сгорании плотных соединительнотканных частей опухоли. После операции раны обрабатывались 5%ным раствором перманганата калия или присыпкой «Банеоцин». Повязки не накладывались.
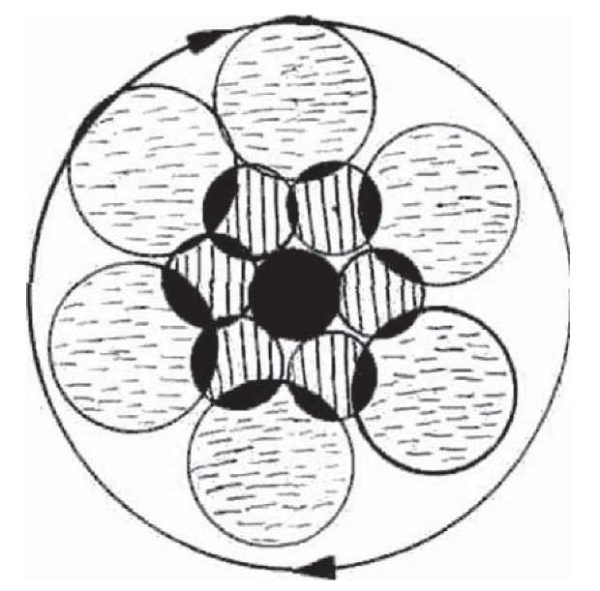
Рис. 2. Схема лазерной фотокоагуляции доброкачественных опухолей
Fig. 2. Scheme of laser photocoagulation of benign tumors
Лазерное иссечение с ушиванием краев раны
Показанием к этому виду оперативного лечения являлись доброкачественные опухоли более 1,0 см в диаметре, если они локализуются на лице, и более 2,5 см – при локализации на других участках тела. В основном эту группу составляли пациенты с фибромами, липомами и папилломами на широком основании, предраковыми заболеваниями кожи, с ретенционными кистами слизистых оболочек и атеромами.
Эти оперативные вмешательства осуществлялись под местной анестезией 0,25–1%-ным раствором лидокаина или новокаина. В эпидермис и дерму трудно ввести достаточное количество анестезирующего вещества, поскольку при рассечении дермы лазером на фоне дефицита жидкости формируется значительная зона коагуляционного некроза и регенерация протекает медленнее, чем при рассечении скальпелем – на одни-двое суток. В связи с этим кожу вначале рассекали обычным скальпелем до ее базального слоя, отступая от видимой границы опухоли на 1–2 мм. При всех операциях обязательно выполняли разметку разрезов и границ удаляемых тканей раствором бриллиантовой зелени, что значительно облегчало как планирование самой операции, так и ее конечный результат. Удаляемый участок с патологическим очагом после рассечения дермы скальпелем брали на зажимы Кохера и с помощью сфокусированного лазерного луча иссекали опухоль, используя 20–40 % мощности установки «Ланцет» (плотность мощности – 0,009–0,018 кВт/мм2, диаметр сфокусированного луча – 1,0 мм). Локализация новообразования на более плотных участках кожи человеческого тела (спина, бедра, ягодичная область) требовала до 60– 80 % мощности установки (плотность мощности – 0,027–0,036 кВт/мм2). По ходу отсепаровки лазерным лучом мелкие кровеносные сосуды коагулировались, а на сосуды более 1,0 мм в диаметре накладывали кровоостанавливающие зажимы. После рассечения этих сосудов лазером зажимы снимали без лигирования, поскольку кровотечения не было.
Рану ушивали синтетической монофиламентной нитью на атравматической игле (4/0–5/0). Швы на теле снимали на 7–8-е сутки, на лице – на 3–5-е сутки. При обширных иссечениях измененной кожи или на участках, где имелся риск избыточного натяжения краев раны с последующей деформацией, использовали различные методы пластики местными тканями.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Средняя продолжительность пребывания на койке составила 6,2 ± 1,6 суток. Ретроспективный анализ статистики госпитализаций в основной и контрольной группе показал отсутствие зависимости от выбора способа удаления опухоли.
Лазерное иссечение новообразований не имеет преимуществ по времени операции в сравнении с традиционными методами, а иногда может даже проигрывать в этом аспекте. В то же время вапоризация по праву считается самым быстрым и комфортным способом удаления, что объясняется возможностью работать в труднодоступных для обычного хирургического инструмента местах (веки, уголки глаз, носогубные складки и т. д.); бесконтактностью процедуры; качественным визуальным контролем; отсутствием кровотечения; бактерицидным действием лазерного излучения. Операция занимала не более 20 минут, луч углекислотного лазера контролируемо выпаривал новообразование до основания без травмирования окружающий тканей. При необходимости можно было выполнить биопсию ткани. Дно лазерной раны закрывал плотный струп, препятствовавший ее инфицированию.
Морфология раны после воздействия излучения СО2-лазера детально описана в научной литературе и не явилась предметом изучения в рамках данной работы [21]. Наши наблюдения подтвердили отсутствие выраженной фазы воспаления. Уже на вторые сутки по периферии раны появлялись клетки, участвующие в регенерации (в контрольной группе они появлялись не ранее 3-х суток). На 7-е сутки отмечался активный процесс ангиогенеза, а к 14-м или 21-м суткам структура ткани восстанавливалась в ряде случаев даже без характерных рубцовых изменений.
Выраженность болевого синдрома в ближайшем послеоперационном периоде при иссечении опухоли с последующей пластикой мягкими тканями и ушиванием раны в обеих группах отличалась незначительно. Однако при вапоризации и электрокоагуляции этот показатель имел существенные различия по интенсивности и продолжительности. В основной группе интенсивность субъективных ощущений по визуально-аналоговой шкале боли была крайне низкой – 1,3 ± 0,2 балла, тогда как в контрольной проявление болевого синдрома оценивалось в 3,2 ± 1,4 балла (рис. 3). При лазерной вапоризации боль воспринималась как небольшое жжение и дискомфорт, исчезающие на вторые сутки. В случаях с электрокоагуляцией болезненность держалась до трех дней.
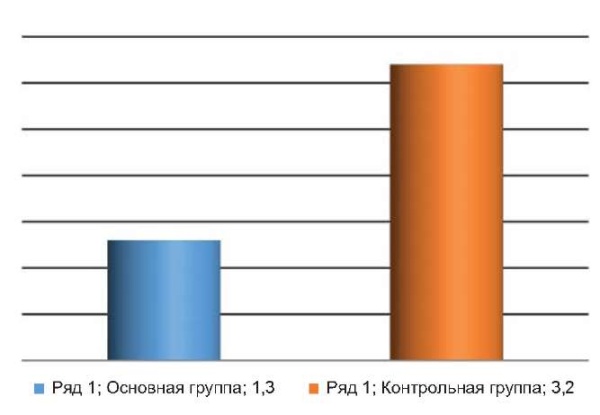
Рис. 3. Интенсивность боли в основной и контрольной группе
Fig. 3. Pain intensity in the main and control groups
В зависимости от локализации швы снимали на 7-е или 10-е сутки. Во всех наблюдениях отмечено заживление раны первичным натяжением. В обеих группах раны заживали с образованием струпа, который в основной группе оставался до 7–10, в контрольной – до 9–12 суток. Время первичного этапа заживления раны в основной группе составило 8,7 ± 1,4, в контрольной – 10,4 ± 2,3 суток (рис. 4).
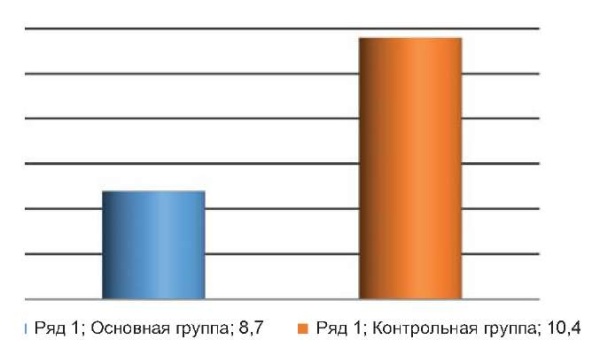
Рис. 4. Время первичного заживления в основной и контрольной группе
Fig. 4. Time of primary healing in the main and control groups
Через 6 мес. у 48 пациентов (4,1 %) основной группы сохранялась депигментация на месте удаленного новообразования, в 10 наблюдениях (0,8 %) было отмечено наличие гипертрофического рубца; в контрольной группе депигментация присутствовала в 62 случаях (29,5 %), у 28 человек (13,3 %) образовались гипертрофические рубцы (рис. 5).
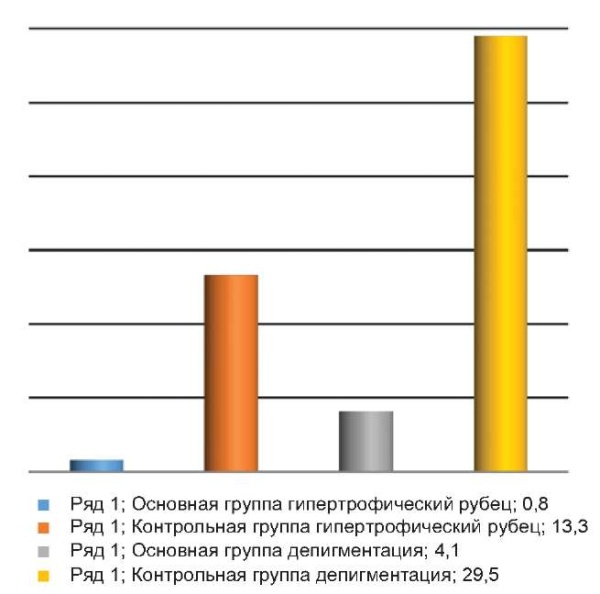
Рис. 5. Депигментация и гипертрофический рубец в основной и контрольной группе
Fig. 5. Depigmentation and hypertrophic scar in the main and control groups
В обеих группах было подтверждено по 2 рецидива папилломы, устраненных при повторном обращении. Эстетическая удовлетворенность больных результатом лечения в интервале первых 3 месяцев, по данным опросов, составила в основной группе 97,4 %, а в контрольной – 85,8 %.
ЗАКЛЮЧЕНИЕ
По результатам анализа полученных данных можно утверждать, что лечение доброкачественных новообразований кожи с применением углекислотного лазера показывает высокую эффективность, которая связана с физическими характеристиками лазерного излучения и особым характером тканевого ответа на его воздействие. Метод демонстрирует полностью контролируемое удаление патологического образования без существенного повреждения окружающих тканей, минимально выраженную воспалительную реакцию в области операции, практически полное отсутствие болевого синдрома, ускорение репаративного процесса, возможность заживления раны без формирования грубого рубца и эстетическую удовлетворенность пациентов результатами лечения.
Список литературы
1. Гейниц А.В., Дремова Е.Е. Современные методы лечения кератозов кожи (Обзор литературы). Лазерная медицина. 2015; 19 (2): 52–56.
2. Мордовцева В.В., Волгин В.Н., Кахишвили Н.Н. Доброкачественные образования кожи, представляющие трудности для диагностики. Дерматология. Приложение к журналу Consilium Medicum. 2012; (1): 26–29.
3. Шуюкова Е.В. Особенности клинической картины доброкачественных эпителиальных опухолей кожи. Национальные проекты: вызовы и решения. Материалы 55-й межрегиональной научно-практической медицинской конференции. Ульяновск; 2020: 123–126.
4. Брянцева Н.Г., Шагров Л.Л., Шутский Н.А. Частота регистрации условно доброкачественных новообразований кожи в практике дерматолога. Бюллетень Северного государственного медицинского университета. 2019; 1 (42): 288–289.
5. Валдина Е.А. Диагностика опухолей кожи в амбулаторных условиях. Стационарозамещающие технологии. Амбулаторная хирургия. 2006; 2 (22): 8–11.
6. Кассиров Д.А., Козлов С.В., Леснова Е.И. Лазерная деструкция доброкачественных опухолей кожи. Новые технологии в онкологии: сборник материалов ежегодной научно-практической конференции, посвященной 100-летию Самарского государственного медицинского университета. 2018: 46–47.
7. Юцковская Я.А., Кизей И.Н., Кусая Н.В. Выбор метода лечения новообразований кожи врачом-дерматокосметологом. Экспериментальная и клиническая дерматокосметология. 2006; (5): 2–9.
8. Grossman P.H., Grossman A.R. Treatment of thermal injuries from CO2-laser resurfacing. Plast Reconstr Surg. 2002; 109 (4): 1435–1442. DOI: 10.1097/00006534-200204010-00036
9. Furukawa F, Mizawa M, Shimizu T. Treatment of dermatosis apulose nigra using a carbon dioxide laser. J Cosmet Dermatol. 2020; 19 (10): 2572–2575. DOI: 10.1111/jocd.13309
10. Майстренок А.М., Саларев В.В. Опыт лечения себорейных кератом СО2-лазером. Достижения фундаментальной, клинической медицины и фармации: материалы 76-й научной сессии ВГМУ. Витебск; 2021: 66–67.
11. Sinha K., Mallipeddi R., Sheth N., Al-Niaimi F. Carbon dioxide laser ablation for trichoepitheliomas: The largest reported series. J Cosmet Laser Ther. 2018; 20 (1): 9–11. DOI: 10.1080/ 14764172.2017.1288257
12. Chavon J.P. Laser, chirurgic et microchirurgic. Principes et applications. La Revue de medicine. 1981; 23(8): 1403– 1407.
13. Васильцов В.В., Галушкин М.Г., Панченко В.Я. Динамические характеристики процесса образования каналов в биотканях под воздействием излучения СО2-лазера. Медицинская физика. 2018; 4 (80): 74–79.
14. Варев Г.А., Давыдов Д.В., Решетов И.В. и др. Выбор режимов работы хирургического СО2-лазера в реконструктивной пластической хирургии. Анналы пластической, реконструктивной и эстетической хирургии. 2017; (1): 50–56.
15. Shostak І., Khrapach V., Kolibaba O., et al. Experience of surgery treatment of lipoma by use of laser technique (Ukraine). American Scientifi c Journal. 2017; 15-1: 25–29.
16. Kirschner R.A. Cutaneous plastic surgery with the CO2 laser. J Surg Clin North Am. 1984; 64 (5): 871–883. DOI: 10.1016/ s0039-6109(16)43430-4
17. Абдулкеримов Х.Т., Светлакова Е.Н., Григорьев С.С. и др. Лазерные технологии. Учебное пособие. Екатеринбург; 2019.
18. Sun M.D., Halpern A.C. Advances in the etiology, detection, and clinical management of seborrheic keratosis. Dermatology. 2021; 238 (2): 205–207. DOI: 10.1159/000517070
19. Бывальцев В.А., Белых Е.Г., Сороковиков В.А., Арсентьева Н.И. Использование шкал и анкет в вертебрологии. Журнал неврологии и психиатрии им. С.С. Корсакова. 2011; 111(9-2): 51–56.
20. Калантаевская К.А. Морфология и физиология кожи человека. 2-е изд., испр. и доп. Киев: Здоровье; 1972.
21. Елисеенко В.И. Патологическая анатомия и патогенез лазерной раны. Лазерная медицина. 2017; 21 (4): 5–10.
Об авторах
Н. А. ДанилинРоссия
Данилин Николай Алексеевич – доктор медицинских наук, профессор, ведущий научный сотрудник
Москва
И. В. Курдяев
Россия
Курдяев Игорь Владиславович – кандидат медицинских наук, старший научный сотрудник
Москва
Рецензия
Для цитирования:
Данилин Н.А., Курдяев И.В. Применение углекислотного лазера в лечении доброкачественных новообразований кожи. Лазерная медицина. 2022;26(1):30-36. https://doi.org/10.37895/2071-8004-2022-26-1-30-36
For citation:
Danilin N.A., Kurdyaev I.V. Carbon dioxide laser in the treatment of benign skin neoplasms. Laser Medicine. 2022;26(1):30-36. (In Russ.) https://doi.org/10.37895/2071-8004-2022-26-1-30-36
JATS XML


























