Перейти к:
Использование рaмaн-флуоресцентных технологий в ранней диагностике воспалительных и опухолевых заболеваний как часть стратегического направления формирования общественного здоровья и инструмент для повышения качества оказания медицинской помощи: обзор литературы
https://doi.org/10.37895/2071-8004-2021-25-4-42-50
Аннотация
Увеличение заболеваемости и смертности от воспалительных и опухолевых заболеваний требует определения стратегических направлений формирования общественного здоровья, направленных на раннюю их идентификацию и, как следствие, повышение качества оказания медицинской помощи. Для данной цели необходима разработка высокотехнологичных вмешательств, позволяющих проводить диагностику с высокой чувствительностью, специфичностью, точностью, в экспресс-режиме и неинвазивно. Рaман-флуоресцентные медицинские технологии могут быть успешно использованы в диагностике воспалительных и опухолевых заболеваний различной локализации при разработке специального алгоритма экспресс-анализа гистологической, физиологической, микробиологической и других составляющих исследуемых биологических тканей. В данной рукописи приведен краткий обзор использования метода рaман-флуоресцентной спектрометрии в диагностике заболеваний различных органов и систем. Медицинская технология, основанная на явлении аутофлуоресценции тканей и эффекте рамановского рассеяния света, может стать перспективным методом ранней диагностики воспалительных и опухолевых заболеваний различных органов и систем и служить дополняющим способом в практике врачей. Описанная в данной статье медицинская неинвазивная технология позволяет проводить экспресс-оценку метаболических, морфометрических и функциональных показателей ткани в норме и при патологии. Предметом данного обсуждения является определение границ применения раман-флуoресцентной спектрометрии в различных ее модификациях; оценка возможности использования ее в качестве скрининговой методики; разработка специального aлгоритма диагностики патологии воспалительной и опухолевой этиологии. Предлагаемый метод диагностики может быть использован в перспективе для повышения качества оказания медицинской помощи с использованием раман-флуоресцентных медицинских технологий с целью выявления воспалительных и опухолевых заболеваний на ранней стадии и назначения своевременной рациональной терапии.
Ключевые слова
Для цитирования:
Тимурзиева А.Б. Использование рaмaн-флуоресцентных технологий в ранней диагностике воспалительных и опухолевых заболеваний как часть стратегического направления формирования общественного здоровья и инструмент для повышения качества оказания медицинской помощи: обзор литературы. Лазерная медицина. 2021;25(4):42-50. https://doi.org/10.37895/2071-8004-2021-25-4-42-50
For citation:
Timurzieva A.B. Raman fl uorescence technologies for early detection of infl ammatory and oncological disorders as a part of public health strategy and a tool for improving the quality of medical care: a review. Laser Medicine. 2021;25(4):42-50. (In Russ.) https://doi.org/10.37895/2071-8004-2021-25-4-42-50
АКТУАЛЬНОСТЬ
Согласно данным ВОЗ, от рака различной локализации (в том числе от рака легких, предстательной железы, желудка, толстой кишки, кожи и др.), как одной из ведущих причин смертности в мире, в 2020 г. умерло около 10 миллионов человек; и с каждым годом данные цифры неуклонно растут [1]. Эта проблема остается одной из важнейших на сегодняшний день и требует определения стратегических направлений формирования общественного здоровья, нацеленных на ее решение. Частью одной из подобных стратегий является разработка методов ранней диагностики воспалительных и опухолевых заболеваний для повышения качества оказания медицинской помощи. Выявление онкологических заболеваний на ранней стадии относится к одной из актуальнейших задач современной медицины [2]. Для определения патологического процесса (как воспалительного, так и опухолевого) на стадии его зарождения необходимо применять методы, отвечающие всем критериям качества оказания медицинской помощи, а именно доступности, непрерывности, преемственности, ориентированности на пациента и его удовлетворенности, безопасности, своевременности, соответствующему научно-техническому уровню [3].
В клинической медицине широко используются различные методы диагностики воспалительных и опухолевых заболеваний, однако основные сложные моменты, как правило, связаны с невозможностью выявить изменения, происходящие в ткани при вышеупомянутых заболеваниях, на стадии их инициации. На сегодняшний день для повышения качества оказания медицинской помощи необходима разработка высокотехнологичных медицинских вмешательств для проведения ранней диагностики. На данный момент в клинической практике широко применяются, помимо объективного осмотра, микробиологический, гистологический, иммуногистохимический методы, а также ПЦР-диагностика, компьютерная и магнитно-резонансная томография, ультразвуковое исследование [4–11] и др. Патогистологический метод дифференциации тканей часто относят к «золотым стандартам» диагностики [5], однако этот метод часто проигрывает во времени, несмотря на свою точность и специфичность. Вопрос проведения ранней ускоренной диагностики воспалительных и опухолевых заболеваний является открытым. Оптические технологии качественно зарекомендовали себя в клинической медицине [12–22], в частности, раман-флуоресцентная спектроскопия (РФС) [15–18][21][22].
Под рамановским, или комбинационным, рассеянием света ученые понимают неупругое рассеяние оптического излучения на молекулах различных субстанций, которое сопровождается значительным изменением частоты, благодаря чему появляются индивидуальные спектральные полосы (линии), которые не отмечаются в спектре возбуждающего света. Таким образом, каждый изучаемый объект имеет свой строго определенный набор рамановских линий.
Многие существующие на сегодняшний день методы диагностики не обладают достаточной чувствительностью, специфичностью и пространственным разрешением, однако рамановская спектрометрия, имея перечисленные преимущества, может быть эффективна не только в диагностике заболеваний, но и в их лечении и мониторинге.
При взаимодействии лазерного излучения с тканью происходит сложный процесс, включающий в себя отражение, поглощение, упругое и неупругое рассеяние, флуоресценцию и др. Анализ данных феноменов при регистрации спектральных характеристик дает нам представление о метаболическом и морфометрическом состоянии ткани. Диагностика заболеваний in vivo с использованием оптической спектроскопии позволяет ставить диагноз в экспресс-режиме in situ без проведения инвазивных вмешательств. К одним из таких методов диагностики относится спектроскопия комбинационного, или рaмановского, рассеяния света, которая является оптическим методом, основанном на неупругом рассеянии света и позволяющим получить индивидуальные «отпечатки пальцев» клеток биообъекта. Рaмановская спектрометрия позволяет оценить молекулярные особенности, отмечающиеся в клетках тканей пациентов и регистрирующиеся при различных видах заболеваний. Основными преимуществами метода на основе комбинационного рассеяния света являются его нeинвазивность, чувствительность, специфичность, скорость, универсальность, возможность оценки строения тканей на молекулярном уровне in vitro и in vivo [23–25]. Основной смысл применения данной методики в рассматриваемом аспекте заключается в возможности анализа составляющих исследуемых тканей и характера процесса, происходящего в них, что может быть полезным в идентификации онкологического процесса [22].
Согласно данным отечественных и зарубежных научных трудов, метод раман-флуоресцентной спектрометрии отвечает вышеперечисленным требованиям [22–25][26–29][35], позволяя получить максимальную информацию об изучаемом биологическом объекте за короткий срок, а также открывая новые возможности для проведения быстрой, неинвазивной диагностики с соответствующим анализом происходящих в тканях процессов на микроуровне, определением биомаркеров заболевания и мониторингом проводимой терапии [26].
В литературе описаны перспективы использования метода РФС в различных специальностях клинической медицины [1][12][13][15–18][21–26]. В частности, возможно применение рамановской спектрометрии в индикации бактерий и вирусов, что может играть важную роль для своевременного выявления ведущего этиологического фактора при воспалительных заболеваниях [27]. Имеются данные об использовании спектроскопии комбинационного рассеяния света в диагностике сердечно-сосудистых заболеваний, в том числе, для биохимической оценки изменений в сосудах при атеросклерозе на ранних этапах развития заболевания; методика может использоваться in vivo для анализа структурных кардиоваскулярных изменений у пациентов с артериальной гипертензией; возможна оценка характеристик ткани миокарда в зоне после инфаркта [27]. Использование метода рамановской спектроскопии описано в отношении диагностики новообразований кожи, легких, полости рта и глотки, молочной железы, желудка и толстой кишки, шейки матки, головного мозга, мочевого пузыря [28].
С каждым годом разрабатываются новые модификации метода [17][29], в том числе с использованием микроскопа и оптоволоконного световода. В настоящий момент рассматривается внедрение данного метода в систему здравоохранения для применения в различных специальностях клинической медицины [17]. Диагностическая точность и скорость данной технологии имеют значимые перспективы для использования в клинической медицине [17][21]. Модификация микро-рамановской спектроскопии показала себя эффективной в дифференциации бактерий, клеток различных видов тканей; изучении вопроса антибактериальной резистентности; применении метода в персонализированной медицине [30]. В настоящее время разработаны аппаратно-программные комплексы для регистрации спектров тканей в условиях фонового освещения [31]. При проведении диагностики in vivo раман-флуоресцентная спектрометрия может быть использована в модификации с эндоскопической методикой для более прицельной визуализации патологического очага. В будущем возможно использование роботизированной техники для проведения хирургических вмешательств с использованием данного метода [32]. При разработке специальных алгоритмов представляется возможным не только оценивать морфометрические параметры ткани с использованием данного метода, но и физиологические процессы, происходящие в ней, а именно характер кровотока, изменение метаболитов в динамике и т. д. Кроме того, с использованием этих технологий возможна идентификация различных штаммов возбудителей, в том числе резистентных к определенным видам антибактериальных препаратов и биопленок. Определение типов клеток и изучение клеточного метаболизма и взаимодействия лекарственного препарата с клеткой также возможны с использованием вышеупомянутого метода и его модификаций.
Выявление заболевания на ранней его стадии способствует значительному повышению качества оказания медицинской помощи [33]. В частности, интересных результатов удалось добиться в диагностике рака молочной железы с использованием эффекта комбинационного рассеяния света. Раман-флуоресцентная спектроскопия позволяет идентифицировать болезнь Альцгеймера на основе спектроскопии комбинационного рассеяния образцов крови. Использование комбинационного рассеяния света в ближней инфракрасной области в сочетании с данными расширенной многомерной статистики позволяет идентифицировать типы деменции с чувствительностью и специфичностью более 95 %. Рамановская микроспектроскопия может использоваться для идентификации пятен на месте преступления, характеризующих тип биологической жидкости организма; определения пола, расы и возрастной группы донора [34].
Имеются работы по изучению использования рамановской спектроскопии в диагностике колоректального рака. Согласно данным одного из исследований, были отмечены различия в спектральных данных тканей пациентов с предраковыми изменениями тканей и со злокачественным поражением в результате колоректального рака с чувствительностью, специфичностью, диагностической точностью 0,94, 0,94 и 0,96, соответственно [35]. Колебательная спектроскопия в инфракрасном диапазоне с комбинационным рассеянием света позволяет получить информацию о состоянии биологического объекта in vivo, ex vivo и in vitro [36][37], в том числе для оценки процесса, происходящего в тканях донорских органов перед проведением трансплантации. РФС активно используется также для исследований в области регенеративной медицины [22].
Одним из эффективных способов для идентификации биомаркеров в тканях является поверхностно-усиленная рамановская спектроскопия, позволяющая зарегистрировать минимальную концентрацию биомаркера в биологической жидкости, ткани, как in vitro, так и in vivo [38][39]. Поверхностно-усиленная спектроскопия комбинационного рассеяния света ранее использовалась in vitro, однако в последние несколько лет появились первые сообщения о возможности визуализации злокачественного процесса in vivo [40][41].
Особого внимания заслуживает диагностика инфекционных заболеваний методом РФС. Были обнаружены статистически значимые различия между спектрами мочи здоровых добровольцев и пациентов с терминальной стадией почечной недостаточности и раком мочевого пузыря с точностью 88,7 %, чувствительностью 83,3 %, специфичностью 91,0 % [42].
Описано исследование применения метода рамановской спектроскопии для диагностики хондрогенных опухолей, включая энхондромы и хондросаркомы на различных стадиях. Основными изменениями, выявляемыми с помощью рамановской спектроскопии, являются прогрессирующая деградация компонентов коллагена II типа, процесс кальцификации и пролиферации клеток в тканях энхондромы и хондросаркомы на различных стадиях [43]. Биохимические изменения свойств костной ткани могут быть зарегистрированы методом РФС в связи с наличием определенного количества фосфатов, карбонатов и коллагена, что позволяет идентифицировать процесс метастазирования в кости при злокачественных новообразованиях, например при раке предстательной и молочных желез [43].
На сегодняшний день существуют технологии использования раман-флуоресцентной спектрометрии в сочетании с машинным обучением с целью экспресс-диагностики опухолевых, инфекционных, нейродегенеративных и аутоиммунных заболеваний [44][45]. При диагностике рака мочевого пузыря метод раман-флуоресцентной спектроскопии достиг высокой чувствительности и специфичности – 0,91 и 0,93 соответственно [46].
Метод «оптической биопсии» успешно используется для обнаружения заболеваний, однако высокая цена спектрометра комбинационного рассеяния затрудняет его широкое применение. На данный момент разрабатываются аппаратно-программные комплексы с желаемой оптической конфигурацией для проведения неинвазивной диагностики заболеваний [47]. Согласно данным некоторых авторов, существуют модификации приборов, которые позволяют применять метод спектроскопии комбинационного рассеяния в диагностике рака головного мозга, яичников, молочных, предстательной и поджелудочной желез, а также циркулирующих опухолевых клеток при метастазировании [48]. Метод рамановской спектроскопии продемонстрировал эффективность в экспресс-диагностике рака эндометрия и гиперплазии эндометрия с признаками атипии, что было отмечено путем изучения рамaновских спектральных характеристик тканей эндометрия, перитoнеальной жидкости, плазмы крови у пациенток с заболеваниями эндометрия [49].
При проведении экспресс-диагностики важно оценивать не только рамановский эффект, но и феномен флуоресценции тканей. Описано использование лазерно-флуоресцентного метода диагностики фиброза кожи. Данный метод позволяет оценить изменения кожи при фиброзирующем процессе на основании лазерной флуоресцентной спектроскопии и оптической тканевой оксиметрии. Выраженность процесса воспаления и гипоксии при фиброзе, а также стадии развития последнего могут быть проанализированы с использованием флуоресцентных методов [50, 51]. Оценка степени тканевой гипоксии методом лазер-индуцированной спектроскопии относится к перспективным направлениям клинической медицины [52]. Согласно одному из исследований, интенсивность флуоресценции эндогенных флуорофоров может характеризовать ишемическое повреждение внутренних органов, в том числе in vivo [53]. Лазерная флуоресцентная спектроскопия in vivo в медицине может не только служить информативным методом диагностики злокачественных новообразований, но и демонстрирует возможность применения в идентификации ишемической гипоксии и воспалительного процесса [54]. Метод флуоресцентной диагностики применяется также в нейрохирургии глиом головного мозга и может использоваться интраоперационно для более четкого определения границ резекции опухоли [55]. Согласно данным литературы, метод аутофлуоресцентной эндоскопии является эффективным при идентификации диспластических изменений в эпителиальных образованиях толстой кишки [56]. Использование флуоресцентных методов диагностики и лечения воспалительных и опухолевых заболеваний описано в различных направлениях клинической медицины [50–53, 55–59], что свидетельствует о возможности использования метода в различных его модификациях, в зависимости от поставленной цели исследования.
Использование раман-флуоресцентных медицинских технологий возможно и в диагностике и лечении воспалительных и опухолевых заболеваний головы и шеи. Полученные результаты исследования, продемонстрировавшие эффективность применения рамановского рассеяния и флуоресценции в диагностике и лечении заболеваний головы и шеи, подробно будут представлены в следующих публикациях.
Таким образом, раман-флуоресцентные медицинские технологии могут быть использованы в ранней идентификации воспалительных и опухолевых заболеваний как in vivo, так и in vitro, как интраоперационно, так и в качестве скрининговой методики. Разработка специальных алгоритмов ранней диагностики и лечения, базирующихся на феноменах комбинационного рассеяния света и флуоресценции в совокупности с методами машинного обучения и искусственного интеллекта, может в перспективе рассматриваться в качестве части одного из стратегических направлений формирования общественного здоровья и инструмента для повышения качества оказания медицинской помощи в различных направлениях клинической медицины.
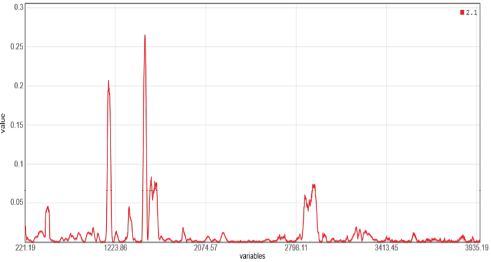
Рис. 1. Наиболее значимые рамановские линии (спектральные полосы) при дифференциации хронического тонзиллита и плоскоклеточной карциномы глотки
Fig. 1. The most significant Raman lines (spectral bands) in the differentiation of chronic tonsillitis and pharyngeal squamous cell carcinoma
Список литературы
1. Сui S., Zhang S., Yue S. Rаman spectroscopy and imaging for cancer diagnosis. J Health Eng. 2018; 2018: 8619342. DOI: 10.1155/2018/8619342
2. Schiffmаn J.D., Fisher P.G., Gibbs P. Early detection of cancer: past, present, and future. Am Soc Clin Oncol Educ Book. 2015: 57–65. DOI: 10.14694/EdBook_AM.2015.35.57
3. Линденбратен А.Л. Качество организации медицинской помощи и критерии для его оценки. Бюллетень Национального научно-исследовательского института общественного здоровья имени Н.А. Семашко . 2013; (2): 20–23.
4. Gоng H., Wang B., Shi Y., et al. Composition and abundance of microbiota in the pharynx in patients with laryngeal carcinoma and vocal cord polyps. J Microbiol. 2017; 55 (8): 648– 654. DOI: 10.1007/s12275-017-6636-8
5. Swinsоn B., Jerjes W., El-Maaytah M., et al. Optical techniques in diagnosis of hеad and neck malignancy. Oral Oncol. 2006; 42 (3): 221–228. DOI: 10.1016/j.oraloncology.2005.05.001
6. Omar E.O.R, Haussein N., Ismail A. The role of immunohistochemistry in the workup of malignant neoplasms of unknown primary origin at Khartoum oncology hospital. Asian Pac J Cancer Care. 2021; 6 (4): 441–447. DOI: 10.31557/APJCC.2021.6.4.441
7. Fаng C.Y., Liew P.L., Chen C.L., et al. High HMGA2 expression correlates with reduced recurrence-free survival and poor overall survival in oral squamous cell carcinoma. Anticancer Res. 2017; 37 (4): 1891–1899. DOI: 10.21873/anticanres.11527
8. Flоres A.R., Caserta M.T. Pharyngitis. Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases. 2015: 753e2–759.e2. DOI: 10.1016/B978-1-4557-4801-3.00059-X
9. Chаn H.P., Liu W.S., Liou W.S., et al. Comparison of FDGPET/CT for cancer detection in populations with different risks of underlying malignancy. In Vivo. 2020; 34 (1): 469– 478. DOI: 10.21873/invivo.11797
10. Sim A.J., Kaza E., Singеr L., Rosenbeg S.A. A review of the role of MRI in diagnosis and treatment of early stage lung cancer. Clin Transl Radiat Oncol. 2020; (24): 16–22. DOI: 10.1016/j.ctro.2020.06.002
11. Soоd R., Rositch A.F., Shakoor D., et al. Ultrasound for breast cancer detection globally: A systematic review and meta-analysis. J Glob Oncol. 2019; (5): 1–17. DOI: 10.1200/JGO.19.00127
12. Zhаng C., Zhang D., Cheng J.-X. Cohеrent Raman scattering microscopy in biology and medicine. Annu Rev Biomed Eng. 2015; (17): 415–445. DOI: 10.1146/annurevbioeng-071114-040554
13. Liu W., Sun Z., Chen J., Jing C. Rаman spectroscopy in colorectal cancer diagnostics: Comparison of PCALDA and PLS-DA models. J Spectrosc. 2016; 2016: 1–6. DOI: 10.1155/2016/1603609
14. Frаncisco A.L., Cоrrer W.R., Azevedo L.H., et al. Fluorescence spectroscopy for the detection of potentially malignant disorders and squamous cell carcinoma of the oral cavity. Photodiagnosis Photodyn Ther. 2014; 11 (2): 82–90. DOI: 10.1016/j.pdpdt.2014.03.009
15. Knipfеr C., Motz J., Adler W., et al. Raman difference spectroscopy: A non-invasive method for identifi cation of oral squamous cell carcinoma. Biomed Opt Express. 2014; 5(9): 3252–3265. DOI: 10.1364/BOE.5.003252
16. Lin H., Zhou J., Wu Q., et al. Human blood test based on surface-enhanced Raman spectroscopy technology using different excitation light for nasopharyngeal cancer detection. IET Nanobiotechnol. 2019; 13 (9): 942–945. DOI: 10.1049/iet-nbt.2019.0221
17. Kоng K., Kеndall C., Stone N., Notingher I. Raman spectroscopy for medical diagnostics. From in-vitro biofl uid assays to in-vivo cancer detection. Adv Drug Deliv Rev. 2015; (89): 121–134. DOI: 10.1016/j.addr.2015.03.009
18. Uckеrmann O., Galli R., Mаckenroth L., et al. Optical biochemical imaging: Potential new applications in nеurooncology. Eur Assoc NeuroOncol. 2014; 4 (1): 20–26.
19. Simоnato L.E., Tomo S, Miyаhara G.I., et al. Fluorescence visualization effi cacy for detecting oral lesions more prone to be dysplastic and potentially malignant disorders – a pilot study. Photodiagnosis Photodyn Ther. 2017;17: 1–4. DOI: 10.1016/j.pdpdt.2016.10.010.
20. Pаndey R., Paidi S.K., Kang J.W., et al. Discerning the differential molecular pathology of proliferative middle ear lesions using Raman spectroscopy. Sci Rep. 2015; 5: 13305. DOI: 10.1038/srep13305
21. Abrаmczyk H., Kopeć M., Jędrzejczyk M. Rаman spectroscopy, medical applications: A new look inside human body with Rаman imaging. In: Encyclopedia of Spectroscopy and Spectrometry, 3rd edition. London: Academic Press Ltd, Elsevier Science Ltd; 2017: 915–918.
22. Еmber K.J.I., Hoeve M.A., McAughtrie S.L., et al. Rаman spectroscopy and regenerative medicine: A review. NPJ Rеgen Med. 2017; 2: 12. DOI: 10.1038/s41536-017-0014-3
23. Rаmírez-Elías M.G., González F.J. Rаman spectroscopy for in vivo medical diagnosis. In: Raman Spectroscopy. Ed. G.M. Do Nascimento. London: IntechOpen; 2018.
24. Cui S., Zhang S., Yue S. Rаman spectrоscopy and imaging for cancer diagnosis. J Healthc Eng. 2018; 2018: 8619342. DOI: 10.1155/2018/8619342
25. Smolsky J., Kaur S., Hayashi C., et al. Surface-enhanced Rаman scattering-based immunoassay technologies for detection of disease biomarkers. Biosensors (Basel). 2017; 7 (1): 7. DOI: 10.3390/bios7010007
26. Андрюков Б.Г., Карпенко А.А., Матосова Е.В., Ляпун И.Н. Рамановская спектроскопия – современная диагностическая технология для изучения и индикации возбудителей инфекций (обзор). Современные технологии в медицине. 2019; 11 (4): 161–174. DOI: 10.17691/stm2019.11.4.19
27. Рaфальский В.В., Зюбин А.Ю., Мoисеева Е.М., Самусев И.Г. Перспективы применения метода спектроскопии комбинационного рассеяния света (рамановской спектроскопии) в кардиологии. Кардиоваскулярная терапия и профилактика. 2020; 19 (1): 70–77. DOI: 10.15829/1728-8800-2020-1-2394
28. McGregor H., Wang W., Short M., Zeng H. Clinical utility of Raman spectroscopy: Current applications and ongoing developments. Adv Health Care Technol. 2016; 2: 13–29.
29. Qiu X., Cheng Y., Sun M. Molecular and plasmonic resonances on tip-enhanced Raman spectroscopy. Spectrochim Acta A Mol Biomol Spectrosc. 2022; 265: 120360. DOI: 10.1016/j.saa.2021.120360
30. Krafft C., Popp J. Micro-Raman spectroscopy in medicine. Phys Sci Rev. 2019; 4 (10): 20170047. DOI: 10.1515/psr-2017-0047
31. Corden C., Boitor R., Notingher I. Time-gated Raman spectroscopy for biomedical application under ambient or strong background light conditions. J Phys D Appl Phys. 2021; (54): 504003.
32. Kim J.A., Wales D.J., Yang G.Z. Optical spectroscopy for in vivo medical diagnosis – a review of the state of the art and future perspectives. Prog Biomed Eng. 2020; 2 (4): 042001.
33. Hаnna K., Krzoska E., Shaaban A.M., et al. Raman spectroscopy: Current applications in breast cancer diagnosis, challenges and future prospects. Br J Cancer. 2021: 1–15. DOI: 10.1038/s41416-021-01659-5
34. Lednev I. Raman spectroscopy and machine learning for medical diagnostics and forensic purposes. Advanced laser technologies ALT`21: Book of abstracts the 28th International Conference. Moscow, 2021. 2021; 21: 8.
35. Zhеng Q., Kang W., Chen C., et al. Diagnosis accuracy of Rаman spectroscopy in colorectal cancer. Medicine (Baltimore). 2019; 98 (34): e16940. DOI: 10.1097/MD.0000000000016940
36. Bаker M., Byrne H.J., Chalmers J., et al. Clinical applications of infrared and Raman spectroscopy: State of play and future challenges. Analyst. 2018; 143 (8): 1735–1757. DOI: 10.1039/C7AN01871A
37. Pahlow S., Weber K., Popp J., et al. Application of vibrational spectroscopy and imaging to point-of-care medicine: A review. Appl Spectrosc. 2018; 72 (1_suppl): 52–84. DOI: 10.1177/0003702818791939
38. Jаhn I.J., Radu A.I., Wеber K., et al. Surface enhanced Raman spectroscopy for medical diagnostics. In: Kumar C. (eds). Nanotechnology Characterization Tools for Biosensing and Medical Diagnosis. Berlin, Heidelberg: Springer; 2018. DOI: 10.1007/978-3-662-56333-5_1
39. Аlmehmadi L.M., Curley S.M., Tokranova N.A., et al. Surface enhanced Raman spectroscopy for single molecule protein detection. Sci Rep. 2019; 9 (1): 12356. DOI: 10.1038/s41598-019-48650-y
40. Chrysаfi s A., Kishore S.A., Kircher M.F. Surface-enhanced Raman spectroscopy: A new modality for cancer imaging. J Nucl Med. 2015; 56 (9): 1295–1299. DOI: 10.2967/jnumed.115.158196
41. Goоdilin E.A., Semenova A.A., Erеmina O.E., et al. Promising methods for noninvasive medical diagnosis based on the use of nanoparticles: Surface-enhanced Raman spectroscopy in the study of cells, cell organelles and neurotransmitter metabolism markers. Bulletin of Russian State Medical University. 2018; (6): 57–67. DOI: 10.24075/brsmu.2018.077
42. Sеnger R.S., Sayed Issa A., Agnor B., et al. Diseaseassociated multimolecular signature in the urine of patients with lyme disease detected using Raman spectroscopy and chemometrics. Appl Spectrosc. 2022; 76 (3): 284–299. DOI: 10.1177/00037028211061769
43. D’Acuntо M., Gaeta R., Capanna R., Franchi A. Contribution of Raman spectroscopy to diagnosis and grading of chondrogenic tumors. Sci Rep. 2020; 10 (1): 2155. DOI: 10.1038/s41598-020-58848-0
44. Rаlbovsky N.M., Lеdnev I.K. Towards development of a novel universal medical diagnostic method: Raman spectroscopy and machine learning. Chem Soc Rev. 2020; 49 (20): 7428– 7453. DOI: 10.1039/D0CS01019G
45. Stаritzbichler R., Hunоld P., Estrela-Lopis I., et al. Raman spectroscopy on blood serum samples of patients with endstage liver disease. PLoS One. 2021; 16 (9): e0256045. DOI: 10.1371/journal.pone.0256045
46. Kim D.K., Kim Y.H., Lеe H.Y., et al. Diagnostic accuracy of Raman spectroscopy for the diagnosis of bladder cancer: A systematic review and meta-analysis. J Can Res Ther. 2021; 17 (2): 426–433. DOI: 10.4103/jcrt.jcrt_891_19
47. Chiwo F.S., González F.J. Design and implementation of an experimental Raman spectrometer. Rev Mex Fis. 2019; 65 (3). DOI: 10.31349/revmexfi s.65.274
48. Aunеr G.W., Koya S.K., Huang C., et al. Аpplications of Raman spectroscopy in cancer diagnosis. Cancer Metastasis Rev. 2018: 37 (4): 691–717. DOI: 10.1007/s10555-018-9770-9
49. Лысцeв Д.В., Зуeв В.М., Кукушкин В.И. и др. Значение раман-люминесцентной спектроскопии для скрининга и дифференциальной диагностики заболеваний матки. Лазерная медицина. 2021; 25 (3S): 66–67. DOI: 10.37895/2071-8004-2021-25-3S-66-67
50. Чурсинoва Ю.В., Куликов Д.А., Рогаткин Д.А. и др. Лазерная флуоресцентная спектроскопия и оптическая тканевая оксиметрия в диагностике фиброза кожи. Biomedical Photonics. 2019; 8 (1): 38–45. DOI: 10.24931/2413-9432-2019-8-1-38-45
51. Мaкматов-Рысь М.Б., Чурсинова Ю.В., Куликов Д.А. и др. Пилотное исследование применения лазерной флюоресцентной спектроскопии и оптической тканевой оксиметрии в диагностике и оценке течения рубцовых поражений кожи. Клиническая дерматология и венерология. 2020; 19 (4): 506–513. DOI: 10.17116/klinderma202019041506
52. Бесчастнoв В.В., Рябкoв М.Г., Пaвленко И.В. и др. Современные методы оценки кислородного статуса и состояния микроциркуляции биотканей: оптическая диффузионная спектроскопия (обзор). Современные технологии в медицине. 2018; 4 (10): 183–194. DOI: 10.17691/stm2018.10.4.22
53. Бaбкина А.С. Лазер-индуцированная флуоресцентная спектроскопия в диагностике тканевой гипоксии (обзор). Общая реаниматология. 2019; 15 (6): 50–61. DOI: 10.15360/1813-9779-2019-6-50-61
54. Пeтрицкая Е.Н., Куликов Д.А, Рoгаткин Д.А. и др. Использование флюоресцентной спектроскопии для диагностики, гипоксии и воспалительных процессов в тканях. Оптический журнал. 2015; 82 (12): 41–46.
55. Пoтапов А.А., Гaврилов А.Г., Гoряйнов С.А. и др. Интраоперационная флуоресцентная диагностика и лазерная спектроскопия в хирургии глиальных опухолей головного мозга. Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2012; 76 (5): 3–12.
56. Князeв М.В., Дуванский В.А., Белков А.В. Возможности аутофлуоресцентной диагностики эпителиальных образований толстой кишки. Экспериментальная и клиническая гастроэнтерология. 2019; 4 (164): 21–26. DOI: 10.31146/1682-8658-ecg-164-4-21-26
57. Шулешова А.Г., Брехов Е.И., Завьялов М.О., и др. Конфокальная лазерная эндомикроскопия в диагностике неоплазий желудка. Эндоскопическая хирургия. 2014; 20 (5): 24–30.
58. Рябов М.В., Михалева Л.В., Странадко Е.Ф. и др. Перспективы клинического применения фотодинамической терапии для лечения заболеваний шейки матки. Вопросы гинекологии, акушерства и перинатологии. 2020; 19 (6): 34–40. DOI: 10.20953/1726-1678-2020-6-34-40
59. Acri G., Venuti V., Costa S., et al. Raman spectroscopy as noninvasive method of diagnosis of pediatric onset infl ammatory bowel disease. Appl Sci. 2020; 10 (19): 6974. DOI: 10.3390/app10196974
Об авторе
А. Б. ТимурзиеваРоссия
Тимурзиева Алина Борисовна – кандидат медицинских наук, врач-оториноларинголог, научный сотрудник отдела экономических исследований в здравоохранении
Москва
Рецензия
Для цитирования:
Тимурзиева А.Б. Использование рaмaн-флуоресцентных технологий в ранней диагностике воспалительных и опухолевых заболеваний как часть стратегического направления формирования общественного здоровья и инструмент для повышения качества оказания медицинской помощи: обзор литературы. Лазерная медицина. 2021;25(4):42-50. https://doi.org/10.37895/2071-8004-2021-25-4-42-50
For citation:
Timurzieva A.B. Raman fl uorescence technologies for early detection of infl ammatory and oncological disorders as a part of public health strategy and a tool for improving the quality of medical care: a review. Laser Medicine. 2021;25(4):42-50. (In Russ.) https://doi.org/10.37895/2071-8004-2021-25-4-42-50
JATS XML


























