Перейти к:
Улучшение результатов лечения пациентов с гнойными заболеваниями пальцев и кисти при использовании лазерного излучения и фотодинамической терапии
https://doi.org/10.37895/2071-8004-2021-25-2-28-40
Аннотация
Несмотря на прогресс в развитии хирургии и фармацевтики, гнойная патология кисти многие годы не теряет лидирующих позиций среди всех заболеваний, с которыми пациенты обращаются в медицинские учреждения. На протяжении многих лет происходит развитие медицинской помощи таким пациентам. Высокая социальная и экономическая значимость данной проблемы заставляет современных хирургов продолжать поиск новых направлений для улучшения результатов лечения пациентов с гнойными заболеваниями кисти, затрагивая не только оперативную технику, но и послеоперационное ведение ран.
Цель исследования: изучение результатов лечения пациентов с гнойными заболеваниями кисти с применением фотодинамической терапии и лазерной некрэктомии. Проведен анализ лечения гнойных заболеваний кисти у 198 пациентов, поступивших в отделение гнойной хирургии ГБУЗ «Городская клиническая больница № 4 Департамента здравоохранения г. Москвы». Всех пациентов в исследовании разделили на четыре группы в зависимости от метода. В 1-й группе (n = 53) после операции рану ушивали и устанавливали дренажно-промывную систему (ДПС); во 2-й группе (n = 50) рану вели открыто в связи с наличием противопоказаний к наложению швов; больным 3-й группы (n = 46) некрэктомию выполняли лазерным лучом, после чего на рану накладывали швы и ДПС; в 4-й группе (n = 49) рану не ушивали, вели под антисептическими повязками (так же как во 2-й группе) в связи с наличием противопоказаний, но выполняли сеанс фотодинамической терапии в раннем послеоперационном периоде. Проанализированы различные аспекты влияния лазерных технологий: динамика раневого процесса, изменение размеров раневого дефекта, уровень болевого синдрома согласно визуальной аналоговой шкале, изменения в клиническом анализе крови, изменения в цитологической картине экссудата из ран, влияние на микрофлору раны. Отмечено ускорение заживления раневого дефекта у всех пациентов, которым проводилось лечение с использованием лазерных технологий, что повлияло и на сроки стационарного пребывания. Влияние лазерного излучения положительно отразилось и на изменениях цитологической и микробиологической картин раневого экссудата, о чем свидетельствовало уменьшение количества раневого детрита и микробных тел в ране. Пациенты, в лечении которых использовали лазер, отметили также уменьшение болевого синдрома сразу после применения методики.
По результатам исследования установлено положительное влияние лазерной некрэктомии при применении ДПС на течение раневого процесса, а применение фотодинамической терапии существенно улучшило результаты лечения пациентов с открытым ведением ран кисти и пальцев. Методики с применением лазерного излучения имеют широкие перспективы для использования в гнойной хирургии кисти.
Ключевые слова
Для цитирования:
Чепурная Ю.Л., Мелконян Г.Г., Гульмурадова Н.Т., Сорокин А.А. Улучшение результатов лечения пациентов с гнойными заболеваниями пальцев и кисти при использовании лазерного излучения и фотодинамической терапии. Лазерная медицина. 2021;25(2):28-40. https://doi.org/10.37895/2071-8004-2021-25-2-28-40
For citation:
Chepurnaya Y.L., Melkonyan G.G., Gulmuradova N.T., Sorokin A.A. Improving the results of treatment of patients with purulent diseases of fingers and hands using laser irradiation and photodynamic therapy. Laser Medicine. 2021;25(2):28-40. (In Russ.) https://doi.org/10.37895/2071-8004-2021-25-2-28-40
ВВЕДЕНИЕ
Несмотря на прогресс в развитии современной хирургии и фармацевтики, гнойная патология кисти многие годы не теряет лидирующих позиций среди всех заболеваний, с которыми пациенты обращаются в медицинские учреждения [1–3]. На протяжении многих лет происходит развитие медицинской помощи таким пациентам. Радикальные изменения произошли не только в хирургической технике, но и в предоперационном обследовании, ведении послеоперационного периода, расширился спектр реабилитационных мероприятий.
В качестве операционной методики методом выбора лечения флегмон и панарициев является техника ведения ран под швами с наложением дренажно-промывной системы (ДПС). Однако существует ряд медицинских противопоказаний к данной технике, и по-прежнему часть ран у пациентов с гнойными заболеваниями кисти хирурги вынуждены вести открытым способом. Кроме того, результаты наложения ДПС зачастую также остаются неудовлетворительными [4].
Высокая социальная и экономическая значимость данной проблемы заставляет современных хирургов продолжать поиск новых направлений для улучшения результатов лечения пациентов с гнойными заболеваниями кисти, затрагивая не только оперативную технику, но и послеоперационное ведение ран.
Положительные результаты в лечении пациентов неоднократно демонстрировали исследователи, использовавшие в своих работах лазерное излучение. В различных областях современной медицины применяют высокоэнергетическое лазерное излучение, в том числе и в качестве скальпеля в гнойной хирургии для выполнения некрэктомии и стерилизации раневой поверхности. Использование лазерной некрэктомии существенно улучшает течение раневого процесса, ускоряет заживление раны, способствует раннему очищению раневого дефекта от фибринового детрита и экссудата [5–7].
Также эффективным методом лечения является фотодинамическая терапия (ФДТ), которая нашла широкое применение в онкологии и гнойной хирургии [8–11].
Использование фотодинамической терапии на послеоперационном этапе позволяет сократить срок заживления раны, способствует раннему появлению грануляций, формированию мягкого рубца, оказывает противомикробное воздействие в ране [12–15].
Однако работ по применению лазерного излучения у пациентов с гнойными заболеваниями кисти крайне мало, что и послужило причиной данного исследования.
Цель данного исследования: изучение результатов лечения пациентов с гнойными заболеваниями кисти с применением фотодинамической терапии и лазерной некрэктомии.
МАТЕРИАЛЫ И МЕТОДЫ
На базе гнойного хирургического и клинико-диагностического отделений ГБУЗ ГКБ № 4 ДЗМ в период с 2017 по 2020 г. провели анализ результатов обследования и лечения 198 пациентов от 18 до 90 лет с гнойными заболеваниями пальцев и кисти.
В исследование включали пациентов со всеми формами гнойной патологии кисти (табл. 1).
Наиболее часто встречавшейся патологией являлись глубокие формы панариция (40,4 %), поверхностные формы встречались реже, что объясняется быстрым прогрессированием данных форм в более тяжелые при отсутствии адекватного лечения. Треть больных (35,3 %) находились на стационарном лечении по поводу флегмон кисти.
Пациентов в исследовании разделили на четыре группы методом случайных чисел (табл. 2). Всем пациентам выполняли оперативное лечение, части пациентов устанавливали дренажно-промывную систему (1-я и 3-я группы), из них 46 (23,2 %) пациентов оперировали с применением некрэктомии высокоэнергетическим лазером «Ланцет-1» (Россия).
Таблица 1
Распределение пациентов по видам гнойной патологии кисти
Table 1
Distribution of patients by the type of hand purulent pathology
|
Вид патологии Types of diseases |
Пол/Sex |
Всего Total |
% |
|
|
мужчины men |
женщины women |
|||
|
Поверхностные формы панариция Superficial forms of panaritium |
21 |
18 |
39 |
19,7 |
|
Глубокие формы панариция Deep forms of panaritium |
56 |
24 |
80 |
40,4 |
|
Фурункулы и карбункулы пальцев Furuncles and carbuncles of fingers |
8 |
1 |
9 |
4,5 |
|
Флегмона кисти Hand phlegmon |
29 |
20 |
49 |
24,7 |
|
Тяжелые формы флегмон кисти Severe forms of hand phlegmons |
16 |
5 |
21 |
10,6 |
|
Всего Total |
130 |
68 |
198 |
100 |
Таблица 2
Способ ведения послеоперационной раны
Table 2
Types of postoperative care
|
Группа Group |
Способ ведения раны Type of wound care |
Число больных Number of patients |
% |
|
|
Контрольная Control |
1 |
Установка ДПС Drainage-lavage system |
53 |
26,8 |
|
2 |
Открытое ведение раны Open wound management |
50 |
25,3 |
|
|
Исследуемая Experimental |
3 |
Установка ДПС + некрэктомия лазером интраоперационно Drainage-lavage system + intraoperative necrectomy with laser scalpel |
46 |
23,2 |
|
4 |
Открытое ведение раны + фотодинамическая терапия Open wound care + photodynamic therapy |
49 |
24,7 |
|
У пациентов, которым установить ДПС не представлялось возможным, применяли открытое ведение раны (2-я и 4-я группы). В 49 (24,7 %) случаях в послеоперационном периоде выполняли сеанс ФДТ лазерным аппаратом «Аткус-2» (ЗАО «Полупроводниковые приборы», Санкт-Петербург) с длиной волны 661 ± 0,3 нм с использованием фотосенсибилизатора «Фотодитазин» (ООО Вета-гранд) в форме 1%-го геля-пенетратора в виде аппликации из расчета 1 мл геля на 1–5 см2 раневой поверхности. Экспозиция препарата в ране составляла 30 минут в бессветовых условиях, согласно инструкции производителя.
В две контрольные группы (1-я и 2-я) включили 103 пациента, из которых 53 (26,8 %) получили лечение по традиционной методике с постановкой ДПС, 50 (25,3 %) пациентам рану не ушивали, а вели под повязками с антисептиками.
Объем и характер оперативного вмешательства определяли с учетом распространенности и локализации гнойного очага, и они отличались в зависимости от нозологической формы. Наложение первичных швов с дренажно-промывной системой считали методом выбора, который следует выполнять после полноценной некрэктомии, гемостаза и при отсутствии выраженного перифокального воспаления. Однако при невозможности первичного закрытия раны целесообразно ее открытое ведение с последующим наложением первично-отсроченных, ранних или поздних вторичных швов. Довольно часто встречались случаи распространенного диффузного гнойного поражения, при котором одномоментная радикальная некрэктомия была технически невозможна. Выраженный отек тканей, поражение кожи вплоть до некроза на всю ее толщу заставляли прибегать к открытому ведению раны. Наличие укушенных ран, выраженной инфильтрации окружающих тканей являлись противопоказаниями к наложению швов. В таких случаях рану дренировали марлевыми турундами и в дальнейшем вели открыто. Разумное применение открытого ведения ран или закрытого способа, а в определенных случаях – их сочетание, позволяли добиться хороших результатов.
Отбор всех пациентов в исследуемых группах проводили методом случайной выборки. Все больные в исследовании сопоставимы по возрасту, полу, локализации, распространенности и тяжести гнойного поражения, сопутствующим заболеваниям.
По результатам анализа частоты заболеваемости у различных групп профессий в зависимости от пола, гнойные заболевания кисти чаще всего встречались у людей трудоспособного возраста от 20 до 60 лет, из них 105 (53 %) мужчин, 42 (21 %) женщины. Наиболее часто гнойными заболеваниями кисти страдали мужчины рабочих профессий. Самой частой причиной данной патологии являлась микротравма – 24 %, а также раны различной этиологии, кроме того, нередко (13,6 %) больные не помнили или отрицали факт какого-либо повреждения.
Макроскопическую оценку течения раневого процесса выполняли с учетом выраженности и продолжительности воспалительных явлений в области раны, также фиксировали сроки полного заживления раневых дефектов. Ежедневно проводили оценку местных проявлений – состояние краев, стенок и дна раны (цвет, количество некрозов, фибринозного налета), состояние окружающих тканей (степень выраженности гиперемии, отека, инфильтрации, болезненность при пальпации зондом), характер раневого отделяемого (гнойное, серозное, сукровичное), количество экссудата (обильное, умеренное, скудное), его запах и цвет, динамику развития грануляционной ткани (сроки, цвет, блеск, зернистость, кровоточивость), динамику эпителизации на различных этапах раневого процесса.
Для оценки сроков заживления гнойных ран измеряли площадь раневой поверхности сразу после операции и на 5-е сутки с определением скорости ускорения заживления. В группах с ушитыми ранами оценка площади раны имела условное сравнительное значение, тогда как в группах с открытым ведением размеры раны имели большое значение для подбора дозы фотосенсибилизирующего препарата, времени воздействия лазерного луча. Кроме того, динамика изменения размеров позволяла оценивать течение и скорость раневого процесса. Размер раны зависел от формы патологии.
Для оценки выраженности интоксикации и воспаления изучали основные показатели общих анализов крови, проводили расчет лейкоцитарного индекса интоксикации (ЛИИ).
Для изучения влияния проводимой терапии на течение раневого процесса использовали цитологические исследования методом мазков-отпечатков раневой поверхности интраоперационно и при открытом ведении раны (во 2-й и 4-й группах), а также цитологическое исследование экссудата из дренажей при установленной ДПС (1-я и 3-я группы). При исследовании учитывали динамику количества клеточных элементов: неизмененных нейтрофильных лейкоцитов, измененных нейтрофилов, незрелых мононуклеарных элементов, макрофагов, юных и зрелых фибробластов и фиброцитов.
Для оценки субъективного болевого синдрома в послеоперационном периоде больному ежедневно при перевязке предлагали оценить степень выраженности боли в баллах согласно стандартной визуальной аналоговой шкале.
Все пациенты в исследовании заполняли подробную анкету и подписывали добровольное информирование согласие на участие в исследовании после подробного объяснения предлагаемого лечения и прочтения брошюры исследования.
В работе применяли методы описательной статистики. При сравнении данных применили дисперсионный анализ (критерий Краскела – Уоллиса), при повторных изменениях применен дисперсионный анализ повторных измерений.
Проводилось сравнение средних величин, включая определение погрешности измерений и достоверности различий параметров между исследуемыми группами. За уровень значимости (р) принято значение менее 0,05. Вычисления выполнены в программе MedCalc Statistical Software version 17.0.4 (MedCalc Software bvba, Бельгия; https://www.medcalc.org; 2017).
РЕЗУЛЬТАТЫ
Динамика течения раневого процесса у больных с гнойными заболеваниями пальцев и кисти после выполнения хирургического вмешательства была различной в зависимости от методики послеоперационного лечения ран.
У пациентов из группы с традиционным оперативным вмешательством с дренажно-промывной системой полное купирование экссудации и отсутствие отделяемого по дренажам отмечено на 9,4 ± 3,1 сут., при этом перифокальные воспалительные явления стихали в среднем на 5,8 ± 1,5 сут.
В 3-й группе, где пациентам была выполнена интраоперационная некрэктомия перед наложением ДПС, дренажи в связи с отсутствием раневого экссудата удалены на 3,3 ± 1,4 сут., при этом перифокальное воспаление существенно регрессировало на 2,5 ± 0,69 сут. Разница данных показателей достоверна в данных группах (р < 0,01), что позволяет считать данные результаты лучшими, по сравнению с другими группами.
У пациентов при открытом ведении ран ежедневно оценивали макроскопическую картину, при этом фиксировали сроки очищения ран от тканевого детрита и воспалительного экссудата, появление первых признаков эпителизации, кроме того, на 5-е сутки выполнялось измерение размеров раневого дефекта.
Во 2-й группе воспалительные явления стихали полностью в среднем на 8,1 ± 1,6 сут., рана очищалась от наложений фибрина и экссудата на 8,2 ± 0,8 сут. Появление грануляций в ране и признаки эпителизации также появлялись в среднем на 7,8 ± 0,8 сут. В 4-й группе после выполнения сеанса ФДТ перифокальное воспаление купировалось в среднем к 5,6 ± 1,2 сут., в эти же сроки рана полностью очищалась от фибринозного налета и появлялись грануляции (на 5,7 ± 1,3 сут.), эпителизация начиналась на 6,2 ± 1,4 сут. Таким образом, применение фотодинамической терапии значительно ускоряет раневой процесс (р < 0,01).
Площадь послеоперационных ран у пациентов в начале лечения составляла от 0,63 до 146 см2 в зависимости от нозологической формы заболевания. В группах с открытым ведением контролировали динамику изменения размеров раневого дефекта для оценки скорости заживления. Согласно научным данным, нормальной считается скорость заживления раны не менее 4 % в сутки. Пациентам 2-й и 4-й групп выполняли измерение размеров раны в конце оперативного вмешательства и на 5-е сутки после операции. В 1-й и 3-й группах измерение площади ран на 5-е сутки не проводили в связи с линейной формой раны и отсутствием видимой динамики площади раневой поверхности.
Во 2-й группе с традиционной методикой ведения послеоперационной раны площадь поверхности раневого дефекта за 5 суток сократилась в среднем на 0,9 см2, что составляло 18,8 % от первоначального размера послеоперационной раны, что свидетельствует о скорости заживления раны менее 4 % в сутки, т. е. о вялотекущем раневом процессе у данных пациентов. В группе пациентов, которым была выполнена фотодинамическая терапия в послеоперационном периоде, на 5-е сутки раневой дефект сократился в среднем на 1 см2, что составило 22,4 % (более 4 % в сутки). Таким образом, площадь раневого дефекта уменьшалась при проведении ФДТ быстрее на 3,4 % за 5 суток: в группе пациентов, которым была выполнена фотодинамическая терапия, процент изменений площади раны на 5-е сутки был статистически значимо больше (р < 0,0001).
При анализе уровня болевого синдрома было выявлено, что лазерное излучение влияет на интенсивность боли. Пациенты, которым интраоперационно некрэктомию выполняли лазерным лучом, отмечали в 1-е сутки после операции болевой синдром существенно ниже, чем пациенты из группы сравнения и пациенты из групп с открытым ведением послеоперационной раны. Пациенты, которым выполняли сеанс фотодинамической терапии, также отмечали снижение боли после сеанса на 2–3 балла, что существенно улучшало качество жизни данных больных не только за счет снижения экссудации, а, следовательно, уменьшения прилипания повязок, но и за счет энергетического воздействия на клетки раны.
Для контроля интоксикационного синдрома в исследовании проводили оценку динамики результатов клинического анализа крови. При поступлении в анализе крови у всех больных отмечен лейкоцитоз с нейтрофильным сдвигом влево, ЛИИ превышал норму, достигая значений от 1,8 до 3,3, в среднем составляя 2,44 ± 0,34. Наиболее значительный темп снижения данного показателя отмечался в 3-й группе и составлял 1,64 ± 0,14, что несущественно превышает нормальные показатели. В 4-й группе также отмечали ускоренное по сравнению с другими группами снижение – 1,73 ± 0,21. В группах с традиционными методиками ЛИИ снижался медленнее, превышая к 5-м суткам нормальные показатели, составляя в 1-й группе – 2,12 ± 0,28, во 2-й – 2,20 ± 0,35. В процессе лечения во всех группах отмечено снижение количества лейкоцитов и уровня ЛИИ, однако в группах, лечение которых проходило с применением лазерного излучения, эндогенная интоксикация купировалась быстрее, что свидетельствует об эффективности лечения (р < 0,001).
Всем пациентам с гнойными заболеваниями кисти выполняли анализ посевов из раны. Результаты микробиологических исследований служили основанием для рационального подбора антибактериальных препаратов. При оценке результатов микробиологического исследования посевов выявлен широкий круг микроорганизмов, представленных как монокультурой, так и в ассоциации. Среди всех патогенных организмов наиболее часто высеивали золотистый стафилококк – в 65 случаях (32,8 %), кишечная палочка выявлена у 22 пациентов (11,11 %), также часто высеивали эпидермальный стафилококк – 13 (6,57 %) случаев, пиогенный стрептококк – 10 (5,05 %) и стрептококк группы В (Str. agalactiae) – 12 (6,06 %). В 3-й группе сразу после воздействия лазерным лучом интраоперационно и в 4-й группе после сеанса ФДТ на 2-е сутки повторно выполняли посев. Во всех случаях результаты были стерильны.
Далее пациентам всех групп выполняли посев на 5-е сутки стационарного лечения. Результаты анализа микробиологических исследований имели существенные различия в зависимости от метода лечения. Так, в 1-й группе повторно выявили микрофлору, идентичную полученной интраоперационно, в 11 случаях, что составило 21,0 % от общего числа пациентов в группе, во 2-й группе повторное микробиологическое исследование выделило исходную микрофлору в 19 (38,0 %) случаях, несмотря на ежедневные перевязки с антисептиками и получаемую антибактериальную терапию. Посев отделяемого из дренажей в 3-й группе было возможно провести лишь у той части пациентов, у которых течение раневого процесса было несколько медленней и дренажи в ране сохраняли до 5 суток – среди них в 2 (4,35 %) случаях получена микрофлора, которую высеивали и интраоперационно. В 4-й группе, пациентам которой выполняли фотодинамическую терапию, в 6 случаях в повторном посеве выявили возбудителей, что составило 12,24 % от группы.
При исследовании чувствительности к антибактериальным препаратам микроорганизмов, высеянных из ран, наибольшее количество выделенных штаммов микроорганизмов оказалось чувствительно к препаратам группы β-лактамов и трициклических гликопротеидов: имипенему (20,4 %), амоксиклаву (24,5 %), ципрофлоксацину (25,9 %) и цефтриаксону (17 %). Полирезистентность отмечена в 2 % случаев.
Таким образом, результаты микробиологического исследования демонстрируют положительное влияние лазерных методик лечения гнойных ран на обсемененность раневой поверхности. Наилучших результатов удалось добиться в группе с интраоперационной обработкой раневой поверхности лучом высокоэнергетического лазера, которая позволила в повторных посевах достигнуть полной стерильности в 98 % случаев. Фотодинамическая терапия также демонстрирует положительные результаты – в повторных посевах микрофлора выявлена лишь в 12,24 %. В обеих группах сразу после воздействия лазерного луча отмечена полная стерильность раневой поверхности.
Анализ результатов цитологических исследований раневых отпечатков и раневого экссудата, полученного из дренажей, позволил оценить характер раневого процесса и эффективности проводимого лечения.
Первичная цитологическая картина характеризовалась стандартной для данной ситуации выраженной воспалительной реакцией (табл. 3).
При сравнительном анализе данных цитограмм на 2-е (табл. 3) и 4-е (табл. 4) сутки отмечены различия в динамике раневого процесса в разных группах в зависимости от метода лечения.
Таблица 3
Цитологические показатели гнойных ран до операции и на 2-е сутки после операции
Table 3
Cytological indicators of purulent wounds before surgery and on day 2 after it
|
Элементы цитограммы, % Cytogram elements, % |
До начала лечения Before treatment |
Группа/Group |
|||
|
1 |
2 |
3 |
4 |
||
|
Нейтрофилы Neutrophils |
98,0 ± 2,1 |
94,2 ± 2,3 |
96,5 ± 2,3 |
90,1 ± 2,2 |
91,6 ± 2,2 |
|
Неизмененные/Unchanged Дистрофически измененные Dystrophic altered |
12,6 ± 1,1 85,4 ± 3,5 |
57.3 ± 2,6 36,9 ± 2,2 |
20,3 ± 2,3 76,2 ± 3,9 |
70,2 ± 3,1 19,9 ± 1,3 |
62,3 ± 2,2 29,3 ± 2,2 |
|
Мононуклеарные фагоциты Mononuclear phagocytes |
2,0 ± 0,3 |
3,7 ± 0,2 |
2,7 ± 0,3 |
6,9 ± 0,4 |
6,5 ± 0,2 |
|
Моноцитарные/Monocytic Зрелые макрофаги/Mature macrophages |
1,6 ± 0,1 0,4 ± 0,1 |
2,4 ± 0,2 1,3 ± 0,1 |
1,9 ± 0,1 0,8 ± 0,1 |
4,6 ± 0,4 2,3 ± 0,4 |
5,3 ± 0,2 1,2 ± 0,1 |
|
Фибробласты/Fibroblasts |
Отс. |
2,1 ± 0,1 |
0,8 ± 0,1 |
2,3 ± 0,1 |
1,9 ± 0,1 |
|
Юные/Young Зрелые/Mature |
Отс. Отс. |
1,7 ± 0,2 0,4 ± 0,1 |
0,8 ± 0,1 Отс. |
2,1 ± 01 1,2 ± 0,1 |
1,6 ± 01 0,3 ± 0,1 |
|
Фиброциты/Fibrocytes |
Отс. |
Отс. |
Отс. |
0,7 ± 0,1 |
— |
|
Эпителий/Epithelium |
Отс. |
Отс. |
Отс. |
Отс. |
— |
|
Детрит/Detritus |
+++ |
++ |
+++ |
+/– |
+/- |
|
Фибрин/Fibrin |
+++ |
++ |
+++ |
+/– |
+ |
|
Микрофлора/Microflora |
+++ |
++ |
+++ |
+/– |
+/– |
|
Незавершенный фагоцитоз Incomplete phagocytosis |
+++ |
++ |
+++ |
+/– |
+/– |
Таблица 4
Цитологические показатели гнойных ран на 4-е сутки после операции
Table 4
Cytological indicators of purulent wounds before surgery and on day 4 after it
|
Элементы цитограммы, % Cytogram elements, % |
Группа/Group |
|||
|
1 |
2 |
3 |
4 |
|
|
Нейтрофилы/Neutrophils |
84,7 ± 2,1 |
91,2 ± 2,3 |
68,5 ± 2,3 |
78,3 ± 2,3 |
|
Неизмененные/Unchanged Дистрофически измененные/Dystrophic altered |
54,4 ± 2,5 30,3 ± 2,2 |
39,9 ± 4,8 51,3 ± 3,6 |
54.3 ± 1,2 13,2 ± 2,4 |
58,1 ± 2,3 20,2 ± 2,2 |
|
Мононуклеарные фагоциты Mononuclear phagocytes |
8,9 ± 0,7 |
7,3 ± 0,4 |
15,8 ± 0,5 |
13,2 ± 0,4 |
|
Моноцитарные/Monocytic Зрелые макрофаги/Mature macrophages |
5,9 ± 0,2 3,0 ± 0,2 |
5,7 ± 0,4 1,6 ± 0,3 |
8,5 ± 0,4 7,3 ± 0,6 |
8,2 ± 0,4 5,0 ± 0,2 |
|
Фибробласты/Fibroblasts |
5,9 ± 0,2 |
1,5 ± 0,1 |
11,7 ± 0,3 |
5,9 ± 0,1 |
|
Юные/Young Зрелые/Mature |
4,1 ± 0,2 1,8 ± 0,1 |
1,5 ± 0,1 Отс. |
8,7 ± 0,3 3,0 ± 0,3 |
4,8 ± 0,1 1,1 ± 0,1 |
|
Фиброциты/Fibrocytes |
0,5 ± 0,1 |
Отс. |
4,0 ± 0,1 |
1,8 ± 0,1 |
|
Эпителий/Epithelium |
+/– |
Отс. |
Отс. |
0,8 ± 0,1 |
|
Детрит/Detritus |
+/– |
++ |
Отс. |
— |
|
Фибрин/Fibrin |
+/– |
+++ |
Отс. |
+/– |
|
Микрофлора/Microflora |
+/– |
++ |
Отс. |
– |
|
Незавершенный фагоцитоз Incomplete phagocytosis |
+/– |
++ |
Отс. |
— |
Течение раневого процесса в 1-й группе соответствовало срокам заживления гнойных ран. В группе с традиционным хирургическим лечением с открытым ведением гнойных ран отмечена цитологическая картина вялотекущего воспалительного процесса с растянутым периодом очищения ран от патогенных микроорганизмов и инородных частиц, что указывает на отсроченное начало пролиферативной стадии воспаления. Выполнение некрэктомии лазерным лучом положительно влияло на течение раневого процесса после операции – изменение цитологической картины демонстрировало ускорение процесса заживления и наиболее быстрый переход от экссудативной фазы раневого процесса к регенераторной. Фотодинамическая терапия также ускорила динамику процесса заживления за счет ускорения процессов клеточной дифференцировки фибробластического ряда, раннего начала эпителизации.
При традиционных методиках лечения гнойных заболеваний кисти пациентам, которым установили дренажно-промывную систему, потребовалась повторная операция в течение первых шести суток в 16 (30,2 %) случаях, из них одному пациенту с пандактилитом 2-го пальца выполнили ампутацию, одному пациенту с пандактилитом 1-го пальца повторную операцию выполняли дважды. При традиционном открытом ведении послеоперационных ран повторную операцию в раннем послеоперационном периоде выполнили у 21 пациента (42,0 % от исследуемой группы), ампутация потребовалась двум пациентам с пандактилитом 1-го и 2-го пальцев, одному пациенту с анаэробной флегмоной кисти и предплечья оперативное лечение выполняли пятикратно (рис. 1).
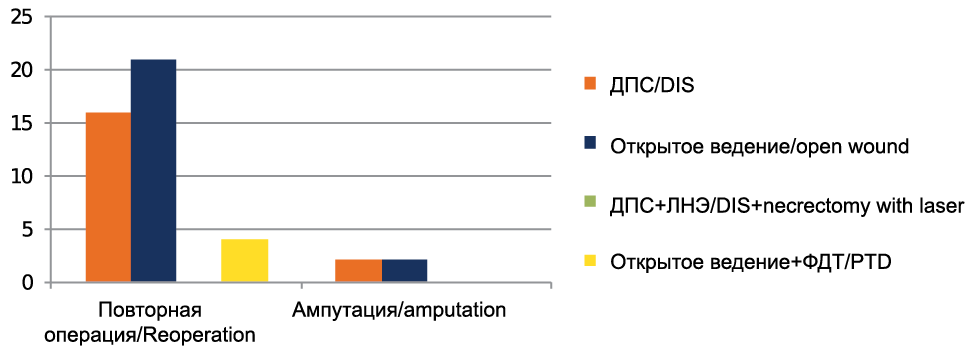
Рис. 1. Частота повторных операций в зависимости от метода лечения
Fig. 1. Rate of repeated surgeries depending on the type of treatment
При выполнении лазерной некрэктомии интраоперационно ни одному больному из группы не потребовалось повторное оперативное лечение. Пациентам, которым при открытом ведении в послеоперационном периоде выполняли сеанс фотодинамической терапии, повторное оперативное лечение потребовалось в 4 (8,2 %) случаях, при этом одному пациенту с анаэробной флегмоной кисти и предплечья повторную некрэктомию выполняли 4 раза.
Стационарный этап лечения у пациентов достоверно различался (р < 0,01) в исследуемых и контрольных группах. В 1-й группе сроки пребывания больных в стационаре в среднем составляли 12,1 ± 2,8 сут., после чего пациенты на протяжении 6,2 ± 1,3 сут. получали медицинскую помощь в амбулаторном порядке, в результате чего сроки полного заживления составляли 18,3 ± 3,7 сут.
В 3-й группе, больным которой до наложения ДПС рану обрабатывали лазерным лучом, сроки как стационарного (6,9 ± 2,6 сут.), так и амбулаторного (5,7 ± 0,8 сут.) этапов были минимальными по сравнению с другими группами.
В группах с открытым ведением сроки заживления ран были статистически значимо выше (р < 0,0001), чем при ушивании, что обусловлено удлинением не только стационарного, но и амбулаторного этапов лечения.
Пациенты 2-й группы находились в стационаре в среднем 14,2 ± 3,7 сут., после чего получали амбулаторную медицинскую помощь на протяжении 7,2 ± 1,1 сут., заживление ран в данной группе протекало замедлено, в среднем 21,5 ± 4,2 сут.
В 4-й группе, где пациенты дополнительно получали фотодинамическую терапию, сроки стационарного лечения составляли 8,0 ± 2,2 сут., амбулаторный этап был более длительным, чем в группах с ушитыми ранами и составил 6,9 ± 0,8 сут., раны заживали полностью к 14,9 ± 2,3 сут.
Ни один пациент, участвовавший в исследовании, не обратился повторно с развитием рецидивного гнойного воспаления. У пациентов, на раны которых воздействовали лазерным излучением, отмечалось формирование более мягких рубцов, которые не подпаивались к окружающим тканям, не ограничивали функцию и визуально выглядели аккуратными.
В качестве иллюстрации успешного применения лазерной некрэктомии и фотодинамической терапии у пациентов с гнойно-воспалительными заболеваниями пальцев и кисти приводим клинические примеры.
КЛИНИЧЕСКИЙ ПРИМЕР 1
Применение лазерной некрэктомии в лечении пандактилита 2-го пальца
Пациент Д., 53 года, поступил в стационар с клинической картиной пандактилита 2-го пальца правой кисти.
В анамнезе травматическое повреждение пальца в быту шилом за 5 суток до поступления, самостоятельно лечился дома (повязки с линиментом синтомицина, прием парацетамола). Обратился за медицинской помощью в связи с нарастанием болевого синдрома, появлением гипертермии до 38,1 °С.
При поступлении отмечен выраженный отек 2-го пальца с переходом на тыл кисти, красноватые полосы распространялись до средней трети предплечья. В области тыльной поверхности проксимального межфалангового сустава имелась рана до 7 мм в диаметре, в дне раны – мелкозернистые грануляции, при пальпации из раны выделяется мутный густой гной с неприятным запахом. Пальпация пальца болезненна, движения в суставах пальца резко ограничены из-за отека, болезненны (рис. 2). Лимфоузлы в подмышечных областях увеличены до 1 см, чувствительны при пальпации. Болевой синдром пациент оценивает на 9 баллов по визуальной аналоговой шкале. На рентгенограммах при госпитализации отчетливо визуализируется дефект костной ткани проксимального межфалангового сустава (рис. 3).
В экстренном порядке выполнена операция: лазерная некрсеквестрэктомия, наложение ДПС (рис. 4). После операции палец иммобилизован гипсовой лангетой. Через 1 сутки после воздействия на гнойный очаг СО2-лазером сохранялся незначительный отек и гиперемия вокруг раны. Отделяемое из раны скудное, серозное. Болевой синдром на 2-е сутки после операции – 6 баллов по ВАШ. ДПС удалена на 3-и сутки после операции. Рана линейной формы, покрыта тонкой коагуляционной корочкой. На рентгенограмме – дефект после резекции проксимального межфалангового сустава (рис. 5).
На 5-е сутки рана полностью очистилась от некротических масс, отека и гиперемии не отмечено (рис. 6). Отделяемого нет. Болевой синдром – 3 балла. Пациент выписан на 7-е сутки. Повторной операции не потребовалось. При амбулаторном наблюдении (рис. 7) отмечалось ускоренное заживление раны с формированием мягкого и эластичного послеоперационного рубца, не ограничивающего движение в пальце. Функция пальца восстановлена практически в полном объеме.
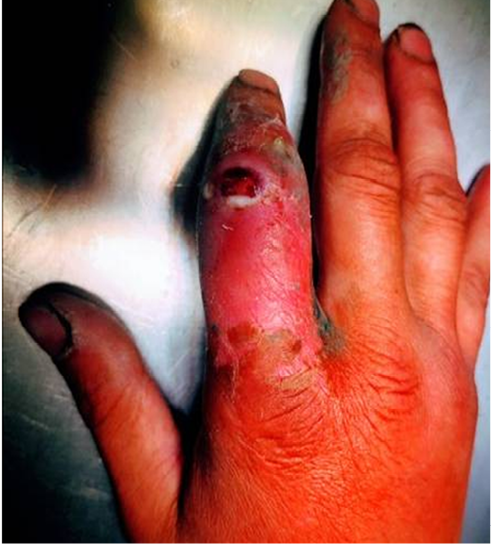
Рис. 2. Макроскопическая картина при поступлении
Fig. 2. Macroscopic picture on admission
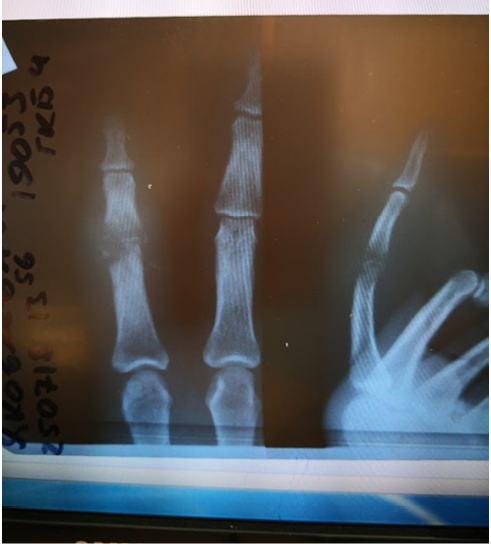
Рис. 3. Рентгенограмма при поступлении
Fig. 3. X-ray picture on admission
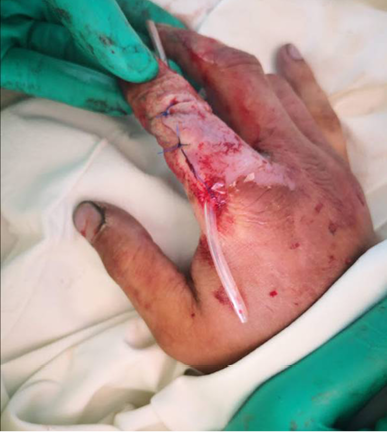
Рис. 4. После операции – лазерная некрсеквестрэктомия
Fig. 4. After surgery – necrectomy with laser light
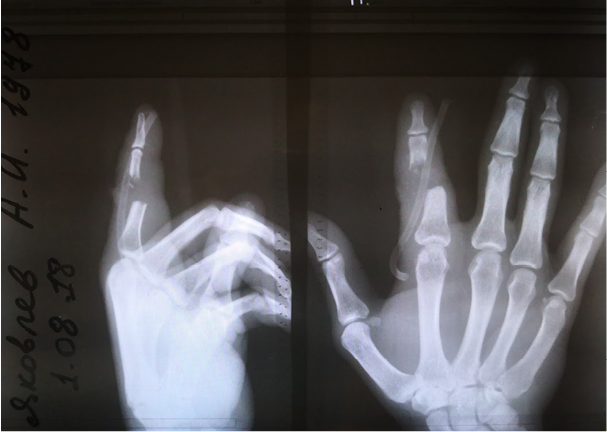
Рис. 5. Рентгенограмма на 2-е сутки после операции
Fig. 5. X-ray picture on day 2 after surgery
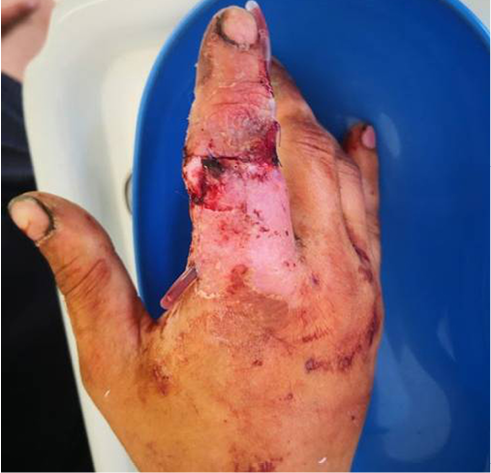
Рис. 6. 5-е сутки после операции
Fig. 6. Day 5 after surgery
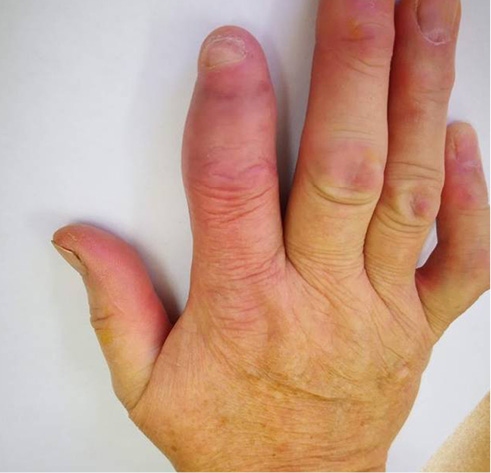
Рис. 7. 3-я неделя после операции
Fig. 7. Three weeks after surgery
КЛИНИЧЕСКИЙ ПРИМЕР 2
Применение ФДТ в лечении пандактилита 1-го пальца
Пациентка М., 48 лет. В анамнезе – укус собственной собакой за сутки до поступления. Самостоятельно не лечилась. При поступлении: 1-й палец левой кисти отечный, гиперемированный, пальпация его резко болезненная, движения в пальце резко ограничены из-за боли и отека. В области основной фаланги две ранки до 3 мм в диаметре, с гнойным отделяемым, вокруг – участок отслоенного гноем эпителия (рис. 8). Субъективный болевой синдром – 8 баллов по ВАШ.
Выполнено оперативное лечение, учитывая этиологию, принято решение от установки ДПС отказаться. Болевой синдром по ВАШ на 1-е сутки после операции – 9 баллов. Сохраняется серозно-гнойное отделяемое (рис. 9).
Сеанс ФДТ выполнен на 2-е сутки после оперативного вмешательства. Пациентка отметила уменьшение боли до 6 баллов через 3–4 часа.
После сеанса наблюдается ускоренное очищение ран, на 1-е сутки после ФДТ резко снизилось количество отделяемого из ран, на 3-и сутки отмечается стихание перифокального воспаления (рис. 10), на 4–6-е сутки происходит формирование грануляционной ткани, воспалительные явления стихают. Формируется сухой струп.
Пациентка выписана из стационара на 9-е сутки. Находилась на амбулаторном наблюдении 7 суток.
Через 12 дней после операции раны практически полностью зажили, послеоперационные рубцы мягкие (рис. 11), светлые, не ограничивающие движения в пальце. Функция пальца восстановилась в полном объеме.
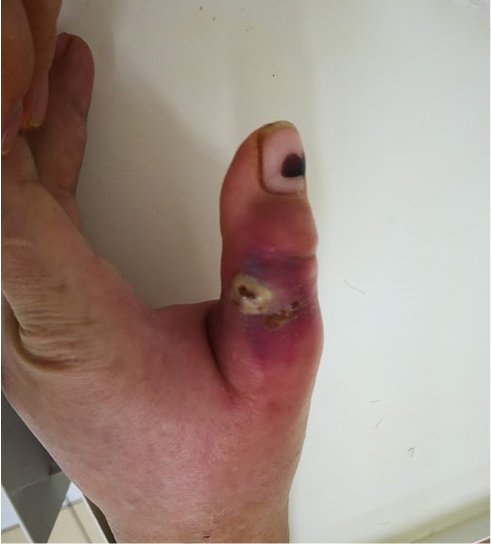
Рис. 8. Клиническая картина при поступлении
Fig. 8. Local status upon admission
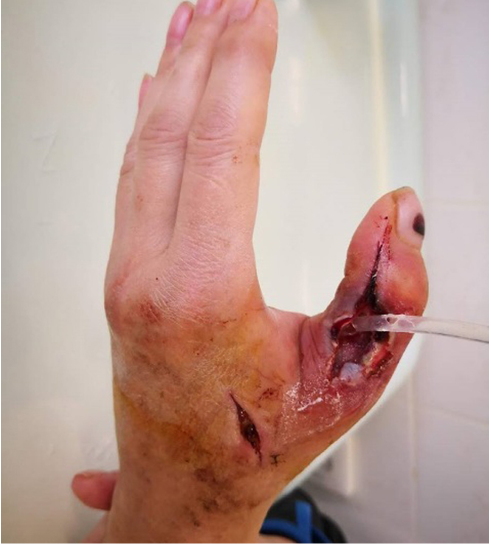
Рис. 9. Местный статус на 1-е сутки после операции
Fig. 9. Local status on day 1 after surgery
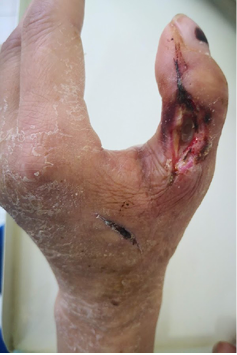
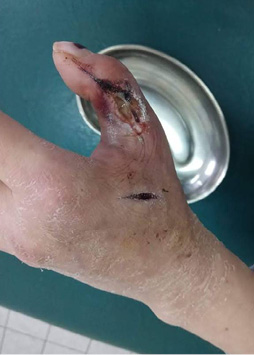
Рис. 10. 3-и сутки после операции
Fig. 10. Day 3 after surgery
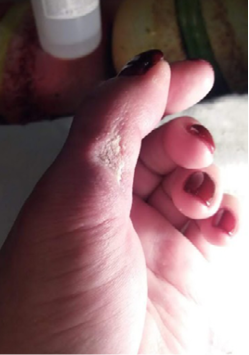
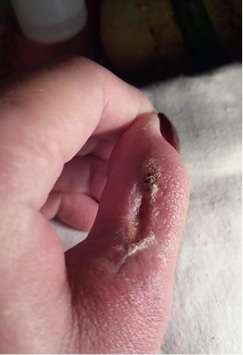
Рис. 11. Амбулаторный этап лечения, 12-е сутки после операции
Fig. 11. Outpatient stage: day 12 after surgery
ОБСУЖДЕНИЕ
В результате проведенного исследования выявлены множественные положительные эффекты после воздействия лучом высокоэнергетического лазера и применения ФДТ у пациентов с гнойной патологией кисти.
Лазерная некрэктомия не имеет противопоказаний для проведения. Малый и регулируемый оператором диаметр лазерного луча, малая глубина воздействия, контролируемый объем резекции являются существенным преимуществом лазерной некрэктомии. Однако применение высокоэнергетических лазеров в хирургии кисти нуждается в тщательной отработке методики и взвешенном подходе оператора для исключения повреждения деликатных анатомических структур, влияющих на функцию всей кисти.
При отсутствии возможности для наложения швов перспективным методом становится фотодинамическая терапия, которая в данном исследовании продемонстрировала противовоспалительный эффект, активацию фагоцитоза и стимуляцию появления грануляций за счет поглощения энергии окружающими тканями, что существенно ускорило репаративные процессы. Особенностью применения данной методики следует считать отсутствие выраженных деструктивных поражений тканей раны, безболезненность процедуры, возможность воздействия на глубоко расположенные ткани. При проведении сеанса ФДТ кровотечение отсутствовало.
Достаточно узкий спектр противопоказаний для проведения ФДТ (наличие у больных тяжелой, неподдающейся коррекции патологии: повышенная чувствительность к препарату, выраженная почечная или печеночная недостаточность, сердечно-сосудистые заболевания в фазе декомпенсации, беременность и период кормления грудью, детский возраст, угроза кровотечения из-за нарушений свертывания крови) позволил проводить данную процедуру у абсолютного большинства пациентов.
Результаты микробиологического исследования продемонстрировали положительное влияние лазерных методик лечения гнойных ран на обсемененность раневой поверхности. Наилучших результатов удалось добиться в группе с интраоперационной обработкой раневой поверхности лучом высокоэнергетического лазера, при выполнении которой в повторном посеве достигнута полная стерильность в 95,7 % случаев. Фотодинамическая терапия также демонстрирует положительные результаты – в повторных посевах микрофлора выявлена лишь в 12,24 %. В 1-й группе сразу после выполнения некрэктомии и во 2-й группе после выполнения сеанса ФДТ лазерного луча отмечена полная стерильность раневой поверхности.
Нормализация ЛИИ и уровня лейкоцитов показателей демонстрирует уменьшение уровня эндогенной интоксикации и свидетельствует об эффективности применения лазерных технологий в лечении гнойных заболеваний пальцев и кисти. Фотодинамическая терапия и лазерная некрэктомия оказывали в группах и анальгезирующее действие, снизив болевой синдром сразу после операции с применением лазерной некрэктомии на 3 балла, а после выполнения сеанса ФДТ – на 2–3 балла. Сроки заживления ран сократились на 6 суток в результате использования высокоэнергетического лазера, при использовании фотодинамической терапии – на 7 суток.
Изменения в исследованных цитологических картинах свидетельствовали об ускоренном переходе из воспалительного типа цитограммы в регенеративный в группах, которым были применены методики с лазерным излучением.
Использование фотодинамической терапии и лазерной некрсеквестрэктомии позволило снизить количество повторных операций в исследуемых группах, а также отказаться от выполнения ампутаций в исследуемых группах.
Ни один пациент, участвовавший в исследовании, не обратился повторно с развитием рецидивного гнойного воспаления. Следует отметить, что пациенты из групп сравнения чаще отмечали ограничение функции пальца или кисти в связи с развитием плотного, спаянного подлежащими тканями рубца. Больные, на раны которых воздействовали лазерным излучением, напротив, отмечали формирование мягких рубцов, которые не подпаивались к окружающим тканям, не ограничивали функцию и визуально выглядели аккуратными.
ЗАКЛЮЧЕНИЕ
Воздействие лазерным лучом создает условия, способствующие более быстрому заживлению гнойной раны. Лазерную некрэктомию с наложением дренажно-промывной системы можно считать методом выбора для лечения гнойных заболеваний кисти. Однако в случаях, когда наложение ДПС невозможно, фотодинамическая терапия при открытом ведении послеоперационной раны положительно влияет на результаты лечения, в 95,4 % случаев позволяя отказаться от повторной операции и ампутации пальца. Быстрое стихание воспаления и раннее начало регенераторной стадии раневого процесса позволили существенно сократить сроки заживления ран (на 7 суток). У пациентов, на раны которых воздействовали лазерным лучом, косметические и функциональные результаты были лучше. Лазерная некрэктомия и фотодинамическая терапия являются эффективными и патогенетически обоснованными способами, повышающими эффективность лечения гнойных заболеваний кисти, и имеют широкие перспективы для клинического использования.
Список литературы
1. Семенова Т.В., Кузнецов Н.А. Специфическая хирургическая инфекция. Клиническая хирургия: национальное руководство: в 3 т. Т. 1. Под ред. В.С. Савельева, А.И. Кириенко. М.: ГЭОТАР-Медиа; 2008: 760–798.
2. Крайнюков П.Е., Матвеев С.А. Хирургия гнойных заболеваний кисти. Руководство для врачей. М.: Планета; 2016: 272.
3. Чадаев А.П., Алексеев М.С., Гаджикеримов Т.А. Комплексное лечение гнойно-воспалительных заболеваний кистевого сустава. Российский медицинский журнал. 2008; (4): 23–28.
4. Baldin A.V., Telich Tarriba J.E., Arroyo F.I., et al. Diagnóstico y tratamiento de las infecciones agudas de mano. Acta Medica Grupo Ángeles. 2018 ; 16 (1): 87–91.
5. Дербенев В.А., Раджабов А.А. Современная стратегия использования лазерного излучения в гнойной хирургии. Лазерная медицина. 2019; 23 (S3): 17–18.
6. Данилин Н.А., Курдяев И.В., Абдулаева С.В. Оценка клинических результатов хирургического лечения келоидных и гипертрофических рубцов с использованием лазера. Лазерная медицина. 2019; 23 (4): 38–44. doi: 10.37895/2071-8004-2019-23-4-38-44
7. Вишняков В.В., Талалаев В.Н., Атлашкин Д.Н. Оценка эффективности использования СО2-лазера в хирургическом лечении больных острым средним отитом с выпотом. Лазерная медицина. 2019; 23 (2): 22–26. doi: 10.37895/2071-8004-2019-23-2-22-26
8. Филоненко Е.В., Серова Л.Г. Фотодинамическая терапия в клинической практике. Biomedical Photonics. 2016; 5 (2): 26–37.
9. Hu X., Huang Y.-Y., Wang Y., Wang X., Hamblin M.R. Antimicrobial photodynamic therapy to control clinically relevant biofilm infections. Front Microbiol. 2018; 9: 1299. doi: 10.3389/fmicb.2018.01299
10. Корабоев У.М., Тепляшин А.С., Странадко Е.Ф. и др. Способ лечения гнойных заболеваний мягких тканей с использованием фотосенсибилизатора «фотосенс» и источников света – лазерного или нелазерного. Лазерная медицина. 1999; 3 (3–4): 80–82.
11. Дуванский В.А., Елисеенко В.И. Эндоскопическая фотодинамическая терапия дуоденальных язв. Лазерная медицина. 2006; 10 (2): 10–14.
12. Дуванский В.А. Фотодинамическая терапия и no-терапия в комплексном лечении больных с трофическими язвами венозного генеза. Лазерная медицина. 2004; 8 (1–2): 3–4.
13. Дуванский В.А., Попова Е.А. Первый опыт применения фотодинамической терапии в комплексном лечении дуоденальных язв. Лазерная медицина. 2004; 8 (3): 217.
14. Шин Е.Ф., Дуванский В.А., Елисеенко В.И. Фотодинамическая терапия экспериментальных огнестрельных ран мягких тканей. Лазерная медицина. 2017; 21 (1): 33–38. doi: 10.37895/2071-8004-2017-21-1-33-38
15. Дербенев В.А., Раджабов А.А., Гусейнов А.И., Исмаилов Г.И. Оценка эффективности использования лазерного излучения для подготовки обширных гнойных ран мягких тканей к пластическим операциям. Лазерная медицина. 2018; 22 (4): 33–39. doi: 10.37895/2071-8004-2018-22-4-33-39
Об авторах
Ю. Л. ЧепурнаяРоссия
Чепурная Юлия Львовна – врач-хирург
г. Москва
Г. Г. Мелконян
Россия
Мелконян Георгий Геннадьевич – доктор медицинских наук, профессор, главный врач; профессор кафедры хирургии
г. Москва
Н. Т. Гульмурадова
Россия
Гульмурадова Наргис Ташпулатовна – доктор медицинских наук, врач-хирург
г. Москва
А. А. Сорокин
Россия
Сорокин Алексей Александрович – хирург
г. Москва
Рецензия
Для цитирования:
Чепурная Ю.Л., Мелконян Г.Г., Гульмурадова Н.Т., Сорокин А.А. Улучшение результатов лечения пациентов с гнойными заболеваниями пальцев и кисти при использовании лазерного излучения и фотодинамической терапии. Лазерная медицина. 2021;25(2):28-40. https://doi.org/10.37895/2071-8004-2021-25-2-28-40
For citation:
Chepurnaya Y.L., Melkonyan G.G., Gulmuradova N.T., Sorokin A.A. Improving the results of treatment of patients with purulent diseases of fingers and hands using laser irradiation and photodynamic therapy. Laser Medicine. 2021;25(2):28-40. (In Russ.) https://doi.org/10.37895/2071-8004-2021-25-2-28-40
JATS XML


























