Перейти к:
Экспериментальное исследование воздействия светокислородного и фотодинамического эффектов на воспалительную реакцию кожных покровов, вызванную гистамином
https://doi.org/10.37895/2071-8004-2024-28-2-8-14
Аннотация
Цель работы. Исследовать сравнительное воздействие светокислородного и фотодинамического эффектов на развитие воспалительной реакции, вызванной гистамином, для изучения механизмов воздействия синглетного кислорода на биологические объекты и для оптимизации применения их в клинической практике.
Материалы и методы. В качестве источника лазерного излучения использовался отечественный диодный лазер «Супер Сэб» с λ ≈ 1265 нм (производство ООО «Новые хирургические технологии», г. Москва). Работа проводилась на 10 самках крыс популяции Wistar массой 250–300 г. Облучение лазером проводили при плотности мощности 0,25 Вт/см 2 (экспозиционная доза – 30 Дж/см 2). Контролем являлись места скарификации без облучения. Проводилось исследование концентрации гистамина в растворе после его облучения этим же лазером с помощью иммуноферментного анализа. Исследование фотодинамического эффекта проводилось на 12 добровольцах при постановке скарификационных проб с гистамином при предварительном нанесении фотосенсибилизатора в виде геля «Фотодитазин» с последующим облучением лазерным аппаратом «Аткус-2» (производства ЗАО «Полупроводниковые приборы, г. Санкт-Петербург) с λ ≈ 662 нм, плотностью мощности 0,3 Вт/см 2 и экспозиционной дозой 50 Дж/см 2. Контролем являлись скарификации без облучения.
Результаты. Получены достоверные результаты у экспериментальных животных (p ≤ 0,01), выявившие снижение воспалительной реакции при облучении мест скарификации с нанесением гистамина по сравнению с контрольной группой. При исследовании облученного in vitro раствора гистамина снижение его концентрации при различных дозах облучения не выявлено. При проведении гистаминовых проб у добровольцев получены достоверные данные (p ≤ 0,05), также выявившие снижение воспалительной реакции по сравнению с контролем при облучении с фотосенсибилизатором.
Заключение. Полученные новые данные могут прояснить некоторые механизмы светокислородной и фотодинамической терапии (СКТ и ФДТ), расширить показания для их клинического применения и послужить отправной точкой для продолжения углубленных исследований в этом направлении. В том числе для определения наличия изменений химической структуры ряда важных биологически активных веществ под влиянием СКТ и ФДТ.
Ключевые слова
Для цитирования:
Алексеев Ю.В., Миславский О.В., Баграмова Г.Э. Экспериментальное исследование воздействия светокислородного и фотодинамического эффектов на воспалительную реакцию кожных покровов, вызванную гистамином. Лазерная медицина. 2024;28(2):8-14. https://doi.org/10.37895/2071-8004-2024-28-2-8-14
For citation:
Alekseev Yu.V., Mislavskiy О.V., Bagramova G.E. An experimental study of light-oxygen and photodynamic effects at histamine induced skin inflammatory reactions. Laser Medicine. 2024;28(2):8-14. (In Russ.) https://doi.org/10.37895/2071-8004-2024-28-2-8-14
ВВЕДЕНИЕ
В научной литературе подробно изложены механизмы повреждения биообъектов за счет генерации синглетного кислорода при возбуждении различных пигментов-фотосенсибилизаторов в аэробных системах – так называемый фотодинамический эффект (ФДЭ) [1]. Гипотеза о возможности повреждения клеток и тканей за счет генерации синглетного кислорода без фотосенсибилизатора (ФС) при прямом фотовозбуждении растворенного в тканях кислорода была высказана российскими исследователями еще в конце 80-х годов прошлого века [2–5]. Эта гипотеза, названная светокислородным эффектом (СКЭ) [6], получила свое подтверждение, однако механизмы реализации СКЭ в биологических объектах до сих пор до конца не выяснены и в настоящее время широко обсуждаются [7]. Для его развития необходимо узкополосное (квазимонохроматическое) излучение в определенных спектральных интервалах, соответствующих полосам поглощения, растворенного в водной среде молекулярного кислорода. В водных системах наибольший выход синглетного кислорода наблюдается при действии света в инфракрасном диапазоне спектра при 1264–1270 нм. На модельных системах экспериментально доказано образование синглетной формы кислорода, растворенного в различных средах в соответствии с парциальным давлением, при прямом лазерном возбуждении в инфракрасной полосе его поглощения [8]. Установлено, что генерация синглетного кислорода в водных средах при СКЭ на 3–4 порядка меньше, чем при ФДЭ, при этом генерация синглетного кислорода в биологических объектах до сих пор напрямую не определена. Тем не менее многочисленные работы подтверждают, что облучение биологических объектов в области основных полос поглощения кислорода вызывает специфические эффекты [9].
За счет генерации синглетного кислорода ФДЭ (трехкомпонентный – фотосенсибилизатор, свет и кислород) и СКЭ (двухкомпонентный – свет и кислород) имеют определенную общность и различия [10]. В комплексе физико-химических и медико-биологических исследований, выполненных за последние два десятилетия, установлены некоторые механизмы биостимулирующего и фотодеструктивного действия ФДЭ и СКЭ. При этом известно, что ФДЭ в зависимости от применяемых методик может оказывать влияние на ряд биологически активных веществ эндогенного происхождения, а следовательно, на микроциркуляцию и протекание воспалительных процессов при его клиническом применении [11]. Однако воздействие ФДЭ и тем более СКЭ на химическую структуру низкомолекулярных биологически активных веществ практически не изучено, хотя показано, что при СКЭ синглетный кислород может изменять структуру белковых молекул [12].
Высказано предположение, что образующийся в биологических объектах синглетный кислород может приводить к следующим процессам.
1. Аллильное замещение в олефинах.
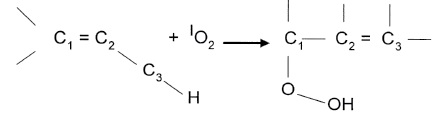
2. [ 2 + 2] – циклоприсоединение к С = С связям с высокой π-электронной плотностью, при этом образуются 1,2-диоксиданы, затем продукты их превращения, например карбонильные соединения:
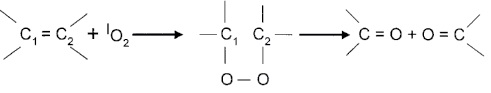
3. [ 4 + 2] – циклоприсоединение к сопряженным диенам (диеновый синтез):
В таком случае генерация синглетного кислорода будет приводить в первую очередь к повреждению клеточных и субклеточных мембран, изменению антигенных свойств органов и тканей, а также к перекисному окислению циклических соединений (пуриновых и пиримидиновых оснований, холестерина, стероидных и половых гормонов, желчных пигментов, порфиринов, гистамина) и алифатических соединений (ненасыщенные жирные кислоты, фосфолипиды, сфигномиелин, цереброзиды), причем степень деструктивного воздействия будет строго зависеть от концентрации синглетного кислорода и, следовательно, от дозы лазерного облучения [13][14].
Ранее нами были получены данные, косвенно свидетельствующие о возможности инактивации гистамина при ФДЭ in vitro и в экспериментах на животных in vivo при оценке скарификационных кожных проб [15].
Из представленных в списке биологически активных веществ, на химическую структуру которых синглетный кислород может оказывать воздействие, особый интерес представляет гистамин, который был нами выбран для модельных экспериментов на лабораторных животных и добровольцах с использованием низкоэнергетических лазерных аппаратов. Известно, что гистамин окисляется кислородом с образованием альдегида, аммиака и перекиси водорода. Альдегиды могут связываться с свободными аминогруппами, вызывать сшивки белков, дезактивируя их, а перекись водорода в зависимости от значения рН раствора может быть как окислителем, так и восстановителем. Как влияет на эти процессы переход эндогенного кислорода в синглетное состояние под влиянием ФДЭ и СКЭ, остается открытым.
Гистамин является одним из эндогенных факторов (медиаторов), участвующих в регуляции жизненно важных функций организма и играющих важную роль в патогенезе ряда болезненных состояний.
Свободный гистамин обладает высокой активностью: он вызывает спазм гладких мышц (включая мышцы бронхов), расширение капилляров и понижение артериального давления; застой крови в капиллярах и увеличение проницаемости их стенок; вызывает отек окружающих тканей и сгущение крови. В связи с рефлекторным возбуждением мозгового вещества надпочечников выделяется адреналин, сужаются артериолы и учащаются сердечные сокращения [16].
В связи с вышеизложенным нами проведено исследование по воздействию ФДЭ и СКЭ на воспалительную реакцию кожи лабораторных животных и добровольцев, вызванную гистамином. Исследование проводилось с целью получения биологических моделей для оценки воздействия синглетного кислорода на биологические мишени.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Исследовать сравнительное воздействие светокислородного и фотодинамического эффектов на развитие воспалительной реакции, вызванной гистамином, для изучения механизмов воздействия синглетного кислорода на биологические объекты и для оптимизации применения их в клинической практике.
МАТЕРИАЛЫ И МЕТОДЫ
Проведенное исследование состояло из трех этапов.
ПЕРВЫЙ ЭТАП ИССЛЕДОВАНИЯ
Проведен эксперимент по воздействию лазерного излучения с длиной волны ≈1265 нм на развитие гистаминовой папулы на коже крыс. Работа проводилась на 10 крысах самках популяции Wistar массой 250–300 г. У животных на спине выстригали участок кожи для нанесения скарификаций. После нанесения иглой скарификации на поверхность кожи из пипеточного дозатора наносили раствор гистамина 0,01 % (гистамина гидрохлорида фирмы Allergopharma, Германия) с концентрацией 5 мг/мл в объеме 20 мкл. Доза гистамина, наносимая на скарификацию, составляла 0,1 мг. Для получения контрольных данных проводили измерение линейкой толщины кожной складки. С интервалом 2 см от контрольных скарификаций наносили экспериментальные скарификации. Далее проводили последующее облучение этих мест отечественным диодным лазером «Супер Сэб» с λ ≈ 1265 нм с непрерывным режимом излучения (производство ООО «Новые хирургические технологии», г. Москва). Облучение проводилось с расстояния 3,5 см при мощности 0,5 Вт в течение 2 мин на площадь 2 см² (плотность мощности 0,25 Вт/см², экспозиционная доза облучения – 30 Дж/см²). Измерение толщины кожной складки у животных (что соответствует размерам гистаминовой папулы у людей) проводили с интервалом 10 мин. в течение 40 мин.
Статистическую обработку полученных данных осуществляли с использованием сред Windows 10 и компьютерной программы Excel 2016.
ВТОРОЙ ЭТАП ИССЛЕДОВАНИЯ
Определение концентрации раствора гистамина in vitro после облучения лазером с длиной волны 1265 нм.
Проведено облучение гистамина в концентрации 100 нг/мл лазером с длиной волны 1265 нм в следующих экспозиционных дозах: 28,8 Дж/см² (0,08 Вт, 180 с); 60 Дж/см² (0,5 Вт, 60 с); 120 Дж/см² (0,5 Вт, 120 с); 420 Дж/см² (0,7 Вт, 300 с); 540 Дж/см² (0,9 Вт, 300 с); 720 Дж/см² (1,2 Вт, 300 с). Облучение раствора гистамина осуществлялось в пробирках типа эппендорф, в объеме 250 мкл, с экспозицией на площадь 0,5 см². Определение концентрации гистамина проводили посредством иммуноферментного анализа (ИФА) с использованием набора Histamine ELISA, фирмы IBL, Германия, и прибора Multiscan MS производства фирмы Labsystems, Финляндия, для определения оптической плотности раствора.
ТРЕТИЙ ЭТАП ИССЛЕДОВАНИЯ
В этом этапе исследования принимали участие 12 здоровых добровольцев. Постановку скарификационных проб с использованием гистамина проводили на коже внутренней стороны предплечья. Для постановки кожных проб с гистамином использовали 0,01 % раствор гистамина. В качестве фотосенсибилизатора использовали 0,1 % гель «Фотодитазин» производства ООО «ВЕТА-ГРАНД», г. Москва, РУ № ФСР 2012/13043. Фотосенсибилизатор наносился за 50 минут до скарификации и перед началом эксперимента тщательно удалялся слабым спиртовым раствором. Облучение проводилось лазерным аппаратом «Аткус-2» (производства ЗАО «Полупроводниковые приборы, г. Санкт-Петербург) с λ ≈ 662 нм, плотностью мощности 0,3 Вт/см². Экспозиционная доза составляла 50 Дж/см². Внутреннюю сторону предплечья у каждого добровольца разделили на 4 участка: 1) контрольный участок – нанесение раствора гистамина (гистаминовая проба); 2) гистаминовая проба без фотосенсибилизатора с облучением аппаратом «Аткус-2»; 3)vгистаминовая проба с нанесением 0,1 % геля фотодитазина без облучения; 4) гистаминовая проба с нанесением 0,1 % геля фотодитазина с последующим облучением аппаратом «Аткус-2». Для предотвращения засветки соседних экспериментальных участков их накрывали тканью. Оценку размера папул проводили через 20 минут после нанесения раствора гистамина.
Статистическую обработку полученных данных осуществляли с использованием сред Windows 10 и компьютерной программы Excel 2016.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
ПЕРВЫЙ ЭТАП ИССЛЕДОВАНИЯ
При учете данных эксперимента начиная с 20-й минуты толщина кожной складки (папулы) при ее облучении незначительно отличалась от контроля – 4,8 ± 0,4 мм, в контроле – 5,4 ± 0,5 мм. Достоверные отличия между экспериментальной и контрольной группой наблюдались на 30-й минуте: толщина кожной складки после облучения лазером «Супер Сэб» с λ ≈ 1265 нм составила 3,9 ± 0,3 мм, в контроле – 5,3 ± 0,7 мм (p ≤ 0,01); на 40-й минуте после облучения – 3,4 ± 0,5 мм, в контроле – 4,6 ± 0,5 мм (p ≤ 0,01). Таким образом, установлено, что применяемые параметры облучения в этом диапазоне достоверно влияют на развитие воспалительного процесса, вызванного гистамином. Результаты эксперимента, проведенного на лабораторных животных, представлены в таблице 1.
Таблица 1
Оценка гистаминовой папулы на коже лабораторных животных после облучения лазером с длиной волны ≈1265 нм
Table 1
Evaluation of the histamine papule on the skin of laboratory animals after irradiation with ≈1265 nm laser light
|
Время t, мин Time t, min |
До нанесения гистамина Before histamine application |
10 мин после нанесения гистамина 10 min after histamine application |
20 мин после нанесения гистамина 20 min after histamine application |
30 мин после нанесения гистамина 30 min after histamine application |
40 мин после нанесения гистамина 40 min after histamine application |
|
Контроль, толщина кожной складки, мм Control, skin fold thickness, mm |
2,5 ± 0,4 |
4,4 ± 0,6 |
5,4 ± 0,5 |
5,3 ± 0,7* |
4,6 ± 0,5** |
|
Эксперимент, толщина кожной складки, мм Experiment, skin fold thickness, mm |
2,6 ± 0,5 |
4,2 ± 0,4 |
4,8 ± 0,4 |
3,9 ± 0,3 |
3,4 ± 0,5 |
P ≤ 0,01*; p ≤ 0,01**
Примечание: использовался критерий Стьюдента.
Note: t-Student criteria was used.
ВТОРОЙ ЭТАП ИССЛЕДОВАНИЯ
Результаты исследования концентрации гистамина после его облучения in vitro показали отсутствие ее изменения при различных дозах лазерного облучения, они представлены в таблице 2 и на рисунке 1. Как видно из представленных данных, концентрация гистамина, определяемая по оптической плотности, практически не изменилась.
Таблица 2
Определение оптической плотности раствора гистамина в концентрации 100 нг/мл по реакции ИФА до облучения лазером с длиной волны 1265 нм и после облучения
Table 2
Determination of the optical density of histamine solution at concentration 100 ng/ml by ELISA reaction before irradiation with 1265 nm laser light and after it
|
Оптическая плотность, ОП Optical density, OD |
0,192 ± 0,015 |
0,195 ± 0,012 |
0,207 ± 0,011 |
0,206 ± 0,010 |
0,204 ± 0,014 |
0,213 ± 0,015 |
0,196 ± 0,016 |
|
Экспозиционная доза облучения, Дж/см² Exposure dose, J/cm² |
0 |
28,8 |
60 |
120 |
420 |
540 |
720 |
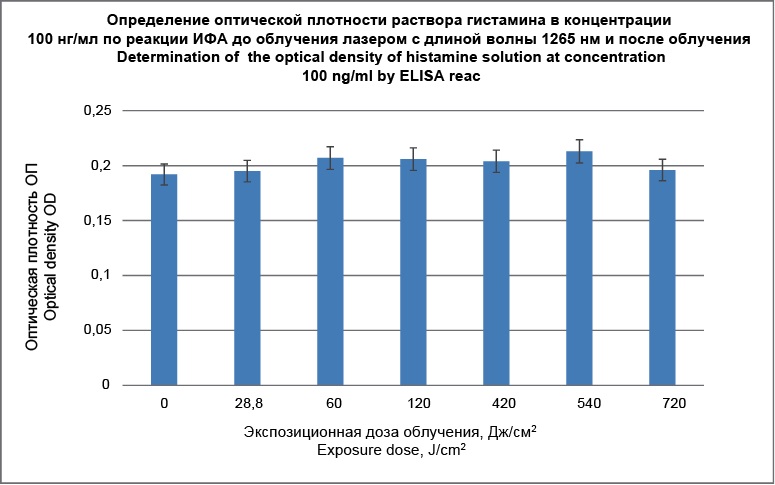
Рис. 1. Определение концентрации раствора гистамина после облучения
Fig. 1. Determination of histamine solution concentration after irradiation
ТРЕТИЙ ЭТАП ИССЛЕДОВАНИЯ
При проведении контрольных гистаминовых проб у добровольцев через 20 минут образовывались папулы размером 5,0 ± 0,6 мм с зоной гиперемии и выраженным зудом. Схожие результаты были получены при сочетании гистаминовых проб с облучением аппаратом «Аткус-2», размеры папул практически не отличались от контроля с гистамином без облучения. Сочетание постановки гистаминовых проб с нанесением фотосенсибилизатора «Фотодитазин» также приводило к появлению папул размером 5,3 ± 0,8 мм. Проведение облучения аппаратом «Аткус-2» после постановки гистаминовых проб с предварительным нанесением геля «Фотодитазин» на кожных участках через 20 минут приводило к появлению папул размером 3,0 ± 0,4 мм, достоверно отличающихся по размеру от данных предыдущих экспериментов (p ≤ 0,05) без гиперемии и зуда.
ОБСУЖДЕНИЕ
Следует сразу отметить, что полученные данные в этой серии экспериментов при их интерпретации ставят больше вопросов о причинах противовоспалительного эффекта с применением модели воспаления, вызванного гистамином, чем дают ответы на механизмы реализации воздействия, генерируемого синглетного кислорода в исследуемых объектах на развитие наблюдаемого процесса.
Парадоксально, но факт, что проведенная серия пилотных экспериментов показала подавление воспалительной реакции как при СКЭ, так и при ФДЭ в течении такого короткого промежутка времени.
При ФДЭ, наряду с другими, пока не выясненными, механизмами противовоспалительного действия можно предположить возможность прямой инактивации гистамина в тканях за счет изменения его химической формулы под воздействием синглетного кислорода. Также инактивация возможна в результате взаимодействия с гистамином продуктов фотолиза фотосенсибилизатора, образующихся при ФДЭ. При СКЭ этот момент маловероятен, так как количество синглетного кислорода, образующегося при нем для прямого воздействия на гистамин, невелико, а фотосенсибилизатор отсутствует. Можно предположить, что оба вида воздействия могут приводить как к увеличению микроциркуляции в местах воздействия, что обуславливает быструю элиминацию гистамина из ткани и, естественно, тем самым снижает его количество, что выражается в уменьшении воспалительной реакции (размер папул), так и к другим эффектам. Но, учитывая биологическую активность синглетного кислорода, вряд ли этот механизм является основным, во всяком случае при ФДЭ. Проведенные ранее исследования механизмов воздействия СКЭ и ФДЭ на структуру белковых молекул могут в той или иной степени объяснить полученные результаты также изменением структуры клеточных рецепторов к гистамину с утратой их чувствительности к нему. Возможны как все перечисленные механизмы, так и какие-либо другие, что нуждается в дальнейшем изучении.
ЗАКЛЮЧЕНИЕ
В пилотных экспериментах определены параметры облучения здоровых тканей, вызывающие противовоспалительный эффект при СКЭ и ФДЭ на модели воспаления, вызванного гистамином.
Заложена основа для продолжения исследований с целью выяснения некоторых аспектов взаимодействия синглетного кислорода с биологическими объектами.
Полученные данные дают основание для использования светокислородной и фотодинамической терапии для местного применения при заболеваниях, имеющих аллергический компонент, и проведение их не является противопоказанием при его наличии.
Результаты проведенных исследований являются лишь отправным моментом для проведения дальнейших исследований на более высоком методическом и техническом уровнях как in vitro, так и in vivo. По-видимому, одним из методов таких исследований для СКЭ и ФДЭ может быть иммуноферментный анализ, дающий достаточно объективную оценку биологически активных соединений при различных видах воздействий на их химическую структуру.
Список литературы
1. Красновский А.А. Синглетный кислород и первичные механизмы фотодинамической и лазерной медицины // Монография: Фундаментальные науки – медицине. Биофизические медицинские технологии. Под редакцией А.И. Григорьева и Ю.А. Владимирова. – МГУ им. М.В. Ломоносова. 2015; 1(2)1: 173–217.
2. Ambartsumian R.V. Lasers in Cardiology // Proceedings of spie volume 0701 1986 European Conf on Optics, Optical Systems and Applications Editor(s): Stefano Sottini; Silvana Trigari. 341–343.
3. Амбарцумян Р.В., Елисеев П.Г., Еремеев Б.В. и др. Биологическое действие лазерного излучения на эритроциты в инфракрасной полосе поглощения молекулярного кислорода. Краткие сообщения по физике. 1987; 10: 35–37.
4. Данилов В.П., Захаров С.Д., Иванов А.В. и др. Фотодинамическое повреждение клеток в красной и ИК полосах поглощения эндогенного кислорода. Доклады АН СССР. 1990; 311(5): 1255–1258.
5. Данилов В.П., Захаров С.Д., Иванов А.В. и др. Спектрально-селективный фотодинамический эффект без экзогенных фотосенсибилизаторов и его возможные применения для фототерапии рака и биостимуляции. Известия АН СССР, Серия Физика. 1990; 54(8): 1610–1620.
6. Захаров С.Д., Иванов А.В. Светокислородный эффект в клетках и перспективы его применения в терапии опухолей. Квантовая электроника. 1999; 29 (3): 192–214.
7. Zakharov S.D., Ivanov A.V. Light-Oxygen Effect as a Physical Mechanism for Activatio of Biosystems by Quasi-Monochromatic Light (A Review). Biophysics. 2005; 50(1): 64–85.
8. Красновский А.А., Дроздова Н.Н., Иванов А.В., Амбарцумян Р.В. Активация молекулярного кислорода инфракрасным лазерным излучением в беспигментных аэробных системах. Биохимия. 2003; 68 (9): 1178–1182.
9. Blázquez-Castro A. Direct 1 O2 optical excitation: A tool for redox biology. Redox Biol. 2017 Oct; 13: 39–59. DOI: 10.1016/j. redox.2017.05.011. Epub 2017 May 25.
10. Алексеев Ю.В., Захаров С.Д., Иванов А.В. Фотодинамический и светокислородный эффекты: общность и различия. Лазерная медицина. 2012; 16(4): 4–9.
11. Дуванский В.А. Влияние фотодинамической терапии на регионарную микроциркуляцию у больных с дуоденальными язвами по данным лазерной допплеровской флоуметрии. Лазерная медицина. 2006; 10(3): 47–51.
12. Алексеев Ю.В., Миславский О.В., Иванов А.В., Дроздова Н.В., Баранов А.В., Дуванский В.А. Изучение воздействия лазерного излучения с длиной волны 1270 нм на специфическое связывание IgG с антигенами S. aureus и на способность стафилококкового энтеротоксина А вызывать специфический иммунный ответ у мышей. Медицинская физика. 2023; 4: 51–60.
13. Гладких С.П., Алексеев Ю.В., Полонский А.К. Молекулярно-биологические основы лазерной и фотодинамической терапии. Новые аспекты лазерной медицины и техники на пороге XXI века. – Москва – Калуга. 2000; 5: 1–35.
14. Гладких С.П., Алексеев Ю.В., Истомин Н.П. Триггерные молекулярные механизмы формирования биологических эффектов при низкоэнергетической лазерной терапии. Лазер-информ. 1996: 7.
15. Алексеев Ю.В., Мазур Е.М., Миславский О.В., Лихачева Е.В., Николаева Е.В., Картусова Л.Н. Экспериментальное подтверждение антигистаминного действия фотодинамической терапии. Лазерная медицина. 2011; 15(2): 59.
16. Медведев А. Е. Гистамин. Большая российская энциклопедия. 2007: 186.
Об авторах
Ю. В. АлексеевРоссия
Алексеев Юрий Витальевич – доктор медицинских наук, руководитель отделения экспериментальной лазерной медицины
121165 Москва, ул. Студенческая, д. 40
О. В. Миславский
Россия
Миславский Олег Владимирович – кандидат фармацевтических наук, старший научный сотрудник отделения экспериментальной лазерной медицины; старший научный сотрудник лаборатории молекулярных механизмов аллергии
121165 Москва, ул. Студенческая, д. 40
115522, г. Москва, Каширское шоссе, д. 24
Г. Э. Баграмова
Россия
Баграмова Гаянэ Эрнстовна – доктор медицинских наук, профессор курса дерматологии кафедры пластической и эстетической хирургии
125371 г. Москва, Волоколамское шоссе, д. 91
Рецензия
Для цитирования:
Алексеев Ю.В., Миславский О.В., Баграмова Г.Э. Экспериментальное исследование воздействия светокислородного и фотодинамического эффектов на воспалительную реакцию кожных покровов, вызванную гистамином. Лазерная медицина. 2024;28(2):8-14. https://doi.org/10.37895/2071-8004-2024-28-2-8-14
For citation:
Alekseev Yu.V., Mislavskiy О.V., Bagramova G.E. An experimental study of light-oxygen and photodynamic effects at histamine induced skin inflammatory reactions. Laser Medicine. 2024;28(2):8-14. (In Russ.) https://doi.org/10.37895/2071-8004-2024-28-2-8-14
JATS XML


























