Перейти к:
Методические замечания о физических параметрах низкоинтенсивного лазерного воздействия. Часть 2. Доза при процедурах лазерной терапии
https://doi.org/10.37895/2071-8004-2024-28-1-8-16
Аннотация
Цель. Общая цель данной методической статьи, состоящей из двух частей, – дать объединяющий теоретический подход к дискутируемым до сих пор проблемам определения глубины проникновения лазерного излучения в ткани и дозы лазерного терапевтического воздействия с позиций современной медицинской физики. Целью второй части статьи является демонстрация возможности оценки дозы воздействия при лазерной терапии по аналогии с классическими дозами в радиобиологии и лучевой терапии.
Материалы и методы. Проведен обзор современного состояния с терминами и определениями, касающимися вопросов определения доз воздействия при использовании ионизирующих и неионизирующих излучений. Методом Монте-Карло смоделирован объем мягких тканей, в котором поглощается до 95 % энергии лазерного излучения. На его основе оценена классическая радиобиологическая поглощенная доза лазерного излучения, измеряемая в греях (Гр). Выполнено численное моделирование поглощенных доз для разных типовых процедур лазерной терапии.
Результаты. Показано, что эффективный облучаемый объем тканей с учетом несущественных вариаций в плотности мягких тканей от пациента к пациенту позволяет вычислять поглощенную дозу излучения в Гр аналогично дозам в радиобиологии. Сравнительные данные по разовой очаговой поглощенной дозе для разных накожных терапевтических процедур не противоречат известным клиническим данным и более контрастно подчеркивают соотношение разных доз для разных целей терапии. Типовые дозы лежат в диапазоне от 0,7 Гр для процедур внутрисосудистого облучения крови до 106 Гр для «разрушающих» процедур фотодинамической терапии и ультрафиолетовой терапии в дерматологии.
Заключение. Предложенный методический подход позволяет по-новому и с единых медико-физических позиций взглянуть на проблему как глубины проникновения лазерного излучения в ткани, так и дозы лазерного воздействия при лечебных и диагностических процедура
Ключевые слова
Для цитирования:
Рогаткин Д.А., Тарасов А.П., Штыфлюк М.Е. Методические замечания о физических параметрах низкоинтенсивного лазерного воздействия. Часть 2. Доза при процедурах лазерной терапии. Лазерная медицина. 2024;28(1):8-16. https://doi.org/10.37895/2071-8004-2024-28-1-8-16
For citation:
Rogatkin D.A., Tarasov A.P., Shtyflyuk M.E. Methodological notes on physical parameters of low-level laser irradiation. Part 2. Light dosage at laser therapeutic sessions. Laser Medicine. 2024;28(1):8-16. (In Russ.) https://doi.org/10.37895/2071-8004-2024-28-1-8-16
ВВЕДЕНИЕ
В первой части статьи был рассмотрен вопрос о глубине проникновения лазерного излучения (ЛИ) в живые ткани и органы при лазерных процедурах терапии и диагностики [1]. Было показано, что в медицинской физике существует несколько подходов к теоретической оценке глубины проникновения ЛИ, которые дают разные числовые результаты. Наиболее практико-ориентированным предложено считать подход, основанный на оценке эффективного облучаемого объема тканей. Во второй части данной статьи этот же подход обосновывается применительно к оценке радиобиологической дозы лазерного терапевтического воздействия.
ПОНЯТИЕ ДОЗЫ ВОЗДЕЙСТВИЯ
Понятие дозы в лазерной медицине более сложное и еще менее формализованное, чем глубины проникновения [2]. В фармакологии доза (от греч. «dosis» – прием, порция) – количество лекарственного или другого действующего вещества, введенного в организм. Для лекарственных препаратов доза выражается в весовых (мг) или объемных единицах измерения (мл) количества введенного вещества на 1 кг веса (массы) тела пациента. Есть понятие и минимальной терапевтической дозы – наименьшее количество препарата, которое еще способно вызвать лечебный эффект. При этом за скобками остается вопрос, сколько из введенного в организм вещества усваивается (поглощается) и оказывает лечебное действие, и сколько не усваивается, а сразу, например, выводится и не участвует в лечении. В общем случае это соотношение индивидуально, но подчиняется законам фармакокинетики, поэтому может быть и оценено теоретически. Тем не менее, назначается именно доза потребления, а также частота (или скорость)1 потребления. На это тоже важно обратить внимание. Если, например, для таблетированной формы препарата назначается разовая доза потребления, скажем, 100 мг три раза в день, то эффекта, скорее всего, не будет, если эти 300 мг будут мелкими порциями потребляться в течение месяца. Одним словом, скорость потребления действующего фактора тоже важна.
В основе использования любого излучения в медицинской физике также лежит количественная оценка его действия на облучаемые ткани и органы и понятие дозы. Этим занимается клиническая дозиметрия. В ней доза облучения – величина энергии излучения, поглощенной в единице массы облучаемого вещества [3]. То есть в классической медицинской физике речь идет, в отличие от фармакологии, не о подведенной энергии, а уже о поглощенной. Поглощенная доза излучения (D) – количество энергии любого излучения (лазерного, ионизирующего), поглощенного в единице массы облучаемой ткани. Эта энергия в случае ионизирующего излучения (при лучевой терапии, например) может быть измерена, и есть метрологически обеспеченные методы и средства для таких измерений. Для этого используются разные тканеэквивалентные фантомы (водяные, пластиковые, желатиновые и пр.), которые имитируют физико-химические свойства реальных биотканей и внутри которых размещают детекторы ионизирующего излучения. Единицей измерения поглощенной дозы является грей (Гр) в честь английского физика и радиобиолога Л. Грея. При поглощении дозы в 1 Гр облучаемому веществу массой в 1 кг передается энергия величиной 1 Дж (т. е. 1 Гр = 1 Дж/кг = 1 мДж/г). Предельной дозой разового внешнего облучения для всего тела человека в радиобиологии считается D = 6 Гр. Без лечения 50 % таких облученных умирают в течение 1–2 месяцев из-за нарушения деятельности клеток костного мозга [4]. При D = 100 Гр смерть наступает уже через несколько часов вследствие необратимого повреждения нейронов центральной нервной системы [4][5]. Но для локального и прицельного лечебного облучения опухолей могут применяться и более высокие дозы. Диапазон локальных (очаговых) доз в лучевой терапии злокачественных новообразований – от 30 до 140 Гр в зависимости от локализации, плотности опухоли и т. д. [6].
При этом, естественно, оценка дозы D в греях не означает, что вся поглощенная эта энергия расходуется на полезное лечебное действие (или на разрушающее опухоль действие). Кроме того, излучение разной природы имеет и разную «силу действия» на ткани и органы. Энергия, переданная тканям на единицу длины пути распространения излучения, зависит как от состава и плотности вещества ткани, так и от природы излучения и энергии его частиц (фотонов, протонов, электронов). Чтобы иметь возможность как-то сравнивать дозу излучений разных видов (α, β, γ и т. д.) в клинической дозиметрии вводится понятие взвешенного радиационного коэффициента kr (коэффициента физической эффективности и/или опасности каждого вида излучения). Для фотонов с энергиями γ-диапазона, например, принято считать kr = 1, для нейтронов с энергией более 20 МэВ kr = 20 и т. д. [3][5]. Нейтроны оказываются в 20 раз опаснее фотонов. Поглощенная доза D, умноженная на коэффициент kr, образует эквивалентную дозу, измеряемую в зивертах [ Зв]2. Это позволяет сравнивать дозы для разных видов излучений с разными энергиями (длинами волн) и пересчитывать их друг в друга. А учет разной чувствительности разных тканей и клеток – некий коэффициент конверсии поглощенной дозы D в некий лечебный или повреждающий (в смысле радиационной безопасности) эффект осуществляется с помощью взвешивающего коэффициента ткани kt – коэффициента биологической эффективности (чувствительности). Он призван учитывать и тип ткани, и ее функциональное состояние. Последнее тоже важно. В частности, в радиологии известно, что для повреждения опухолевой клетки в фазе деления достаточно D = 1 Гр, а для покоящейся клетки нередко недостаточно и 10 Гр [6]. Поэтому для целей терапии может вычисляться еще и эффективная доза, равная произведению D на kt. Однако она для измерений метрологически уже не обеспечена, поэтому сегодня может быть оценена только теоретически. Например, принимается для нормальной кожи kt = 0,01; для ткани легкого – kt = 0,12 и т. д. [3].
Похожий подход с введением коэффициентов эффективности можно встретить и в лазерной медицине, правда, намного реже. Например, в [7] был предложен некий аналог коэффициента эффективности для фотомодификации крови. В фотодинамической терапии (ФДТ) такие коэффициенты учитывают концентрацию фотосенсибилизатора и парциальное давление кислорода в тканях [8]. Однако их расчет сложен и выходит за рамки темы нашей статьи. Но есть и одно принципиальное отличие, которое и послужило причиной нескончаемых споров о дозах в лазерной терапии. Заключается оно в том, что наиболее часто используемым параметром «дозы» при назначении лазеротерапии является не Гр, а величина с размерностью мДж/см 2 либо величина с размерностью мВт/см 2 [1][2][5][9–12 и др.]. Первая в физике носит название энергетическая экспозиция (поверхностная плотность энергии) и равна произведению мощности ЛИ на время его действия, деленному на площадь облучаемой поверхности [13]:
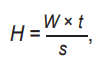 (1)
(1)
где H – энергетическая экспозиция [мДж/см 2], W – мощность [мВт], t – время облучения [с], S – площадь облучения [см 2].
Вторая величина есть поверхностная плотность мощности P и определяется как
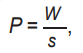 (2)
(2)
где P в лазерной терапии часто измеряется в мВт/см 2.
Но в оптике P имеет и другое уникальное название – освещенность поверхности [13][14]. В том числе, интересно и важно для проблемы доз ЛИ, что с учетом классических определений скорости и мощности в физике, формально, освещенность P может считаться еще и скоростью нарастания энергетической экспозиции H, а также ее мощностью. В публикациях же по лечебному использованию ЛИ и та и другая величины именуются часто именно дозой. Однако строго, как мы видим, в рамках формальных определений это не доза, а скорее сленг [15]. Но сегодня с позиций медицинской физики можно, видимо, примирить эти два подхода в определении дозы.
Исторически привязка терапевтической дозы ЛИ к плотности мощности или энергетической экспозиции основана, наиболее вероятно, на результатах первых экспериментов по лечению открытых ран на животных [16]. Так, в [17] показано, что при воздействии излучением He-Ne и аргонового лазеров с P = 45 мВт/см 2 биологический отклик в ткани ран связан с усилением синтеза коллагенов. При этом оптимальный терапевтический эффект был достигнут при энергетической экспозиции H ~ 4 Дж/см 2. В то же время в [18] аналогичный терапевтический эффект достигнут при более низкой H ~ 1,22 Дж/см 2. При этом использовался He-Ne лазер c P = 4 мВт/см 2, что на порядок меньше, чем в [17]. Несмотря на то что механизм активации синтеза коллагенов неясен и нет однозначного соответствия экспозиции H наблюдаемому терапевтическому эффекту, в лазерной терапии в качестве предельного уровня (максимальной дозы) воздействия ЛИ на ткани по результатам этих работ была рекомендована величина «дозы» в 4 Дж/см 2.
Но есть и другая причина принятия величин H и P в качестве «дозы». Если величину подведенной энергии или мощности ЛИ к поверхности кожи (величину H или P) легко измерить до или во время процедуры терапии, то поглощенную в ткани энергию ЛИ, а также массу облученной ткани считается, что определить трудно. Безусловно, in vivo прямые измерения поглощенной дозы D здесь затруднительны. Однако косвенно, если измерить мощность (энергию) ЛИ, прошедшего насквозь орган и вышедшего назад с передней поверхности за счет обратного рассеяния, то, зная исходную подведенную мощность (энергию), путем вычитания из нее измеренных значений легко определить энергию, поглощенную в органе. В свое время этот раздел биофотометрии по измерению прошедших и отраженных оптических потоков с целью уточнения поглощенной энергии ЛИ в тканях при лазерной терапии достаточно интенсивно развивался в нашей стране [19]. Также доступны сегодня измерения на фантомах, не говоря уже про теоретические оценки.
В первой части статьи (см. [1]) было показано, что методом статистического моделирования Монте-Карло сегодня легко можно оценить реальный объем мягких тканей V95, в котором поглощается до 95 % энергии лазерного излучения при терапевтических процедурах, а также определить эффективную глубину zэф, до которой доходит терапевтическое ЛИ. Как ни странно, но этот подход позволяет вычислять и классическую поглощенную дозу D для ЛИ, если известны коэффициент поглощения ЛИ в тканях μа [см-1] для заданной длины волны, коэффициент рассеяния μs [см-1] и средний косинус угла рассеяния g. Сегодня эти оптические свойства тканей измерить in vivo – не очень сложная задача. Таких стандартных зарегистрированных в РФ приборов пока нет, но сами методы давно разработаны и могут быть реализованы в клинике. Соответственно, легко провести на компьютере и все необходимые вычисления, определяя у каждого пациента при назначении курса терапии индивидуальный объем V %, где проценты означают процент поглощенной в объеме тканей энергии ЛИ от общей падающей на ткани энергии. Безусловно, точность определения оптических свойств – отдельная проблема. Но и обоснования точного выбора индивидуальных значений P и H, чтобы лечить больного, а не болезнь, тоже пока нет. Есть интервалы. Поэтому в пределах существующих разбросов по «дозам» (иногда порядки), небольшие ошибки в определении, μа, μs и g не кажутся столь значимыми. И мы не утверждаем, что так обязательно надо поступать в клинике. Это вопрос практикующих клиницистов. Мы говорим лишь о возможности такого подхода и о его преимуществах в методическом плане для понимания проблемы дозировок в лазерной терапии и, возможно, их оптимизации.
Для этого надо обратить внимание на то, что для мягких тканей и кожи их плотность ρ с очень большой точностью можно считать величиной постоянной, порядка 0,95 г/см 3 для всех людей (взвешенное значение плотности воды и жира, из которых мы состоим на 90 % и более). Тогда, зная объем V, не составляет труда определить и массу m основных облученных тканей внутри него (m = ρV). В рассмотренной в [1] задаче равномерного освещения поверхности S кожи широким лучом зеленого лазера с длиной волны λ = 525 нм с исходной мощностью ЛИ в луче W для модели кожи, состоящей из двух слоев (эпидермис толщиной 100 мкм и дерма, толщина которой принята полубесконечной), и оптических свойств слоев кожи, взятых из [20], при S = 1,76 см 2 (пятно диаметром 1,5 см) объем V95 был оценен в 0,23 см 3. Тогда масса облученных тканей составит ~ 0,22 г (0,95·0,23). Если лазер был непрерывным с W = 10 мВт, то дозу D в греях, поглощенную в объеме V95, при времени облучения, скажем, t = 5 мин (300 с), в рассмотренной задаче легко посчитать. Она будет определяться из уравнений:
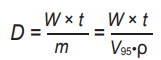 (3)
(3)
и будет равна для λ = 525 нм D = 1,36 × 10 4 Гр. При тех же условиях освещения для λ = 633 нм, D = 5,0 × 103 Гр, т. к. эффективная глубина проникновения для красного света больше, чем для зеленого (3,5 мм для красного против 1,3 мм для зеленого, см. [1]). Красным светом при равной мощности облучается объем больше, поэтому поглощенных фотонов на единицу массы вещества оказывается меньше.
В целом же эти дозы получаются в тысячу раз больше разовых очаговых доз в радиотерапии, но это полностью физически объяснимо: опасность света видимого диапазона спектра по сравнению с ионизирующим γ-излучением в сотни, если не тысячи, раз меньше (энергия кванта света в видимом диапазоне спектра равна порядка 2–3 эВ, а γ-кванта (фотона) в радиотерапии – около 1,2 МэВ (изотоп 60Co), что в 500 тысяч раз больше, поэтому радиационный коэффициент для ЛИ видимого диапазона спектра должен удовлетворять условию kr<<1.
По шаблону рассмотренной задачи, меняя величину освещенности поверхности P0 и время облучения t, можно оценить поглощенные дозы D в объеме V95 для разных типовых накожных процедур лазерной терапии. Такие сравнительные данные для площади облучения S = 1,76 см 2 и типовых параметров воздействия при разных процедурах приведены в таблице.
Отчетливо видно, что дозы D в лазерной терапии при любых поверхностных типовых процедурах существенно выше доз ионизирующего излучения в радиотерапии (30–140 Гр), что логично, т. к. для ЛИ kr<<1. Также отчетливо видно, что «угнетающие» терапевтические методики (УФ-терапия, ФДТ) имеют дозы, минимум на порядок выше лечебных (стимулирующих) доз в НИЛТ. Причем D в УФ-терапии на порядок меньше доз ФДТ вследствие большей энергии кванта света, меньшей zэф и вследствие отсутствия необходимости столь сильного фотоповреждения, как при ФДТ (апоптоз, некроз и т. д.). Все это органично соответствует существующему пониманию механизмов действия ЛИ и происходящих при терапии процессов. Поэтому предложенный подход оценки поглощенных доз D можно признать достаточно успешным, позволяющим в том числе сравнивать дозировки разных лазерных терапевтических процедур (и диагностических по аналогии [21]), что ранее, при использовании только величин P и H, было затруднительно.
Что еще важно отметить, анализируя приведенную теоретическую задачу, так это то, что относительное распределение поглощенного ЛИ по объему V% и сам объем V% не зависят от длительности облучения t. Это, фактически, мгновенное (одномоментное) распределение мощности дозы D или скорости ее нарастания внутри биоткани. Не зависит V95 и от абсолютной величины P0, т. к. определяется как доля. Но от абсолютного значения P0 зависит абсолютная величина поглощенной объемной плотности мощности в среде U [мВт/см 3], а также величина оставшихся 5 % мощности ЛИ, не вошедших в V95. Следовательно, от величины освещенности поверхности P0 зависит обоснование выбора той или иной изодозы (V95, V98 и т. д.), внутри которой U еще превышает порог минимальной удельной терапевтической мощности Umin (сам порог зависит от органа, длины волны и рассматриваемого механизма действия ЛИ). А от выбранного процента мощности (изодозы), в свою очередь, будет сильно зависеть и конкретное значение zэф. Поэтому, видимо, давно подмечено, что импульсное ЛИ часто намного эффективнее непрерывного и проникает глубже [9][11][12]. Это объясняется тем, что в импульсе P0, как правило, намного больше, чем при непрерывном облучении. Следовательно, при прочих равных условиях от импульсного источника излучения объемная плотность мощности U > Umin сформируется в более глубоких слоях биоткани. Но и в более поверхностных слоях объемная плотность мощности тоже будет выше на интервалах времени, достаточных для протекания фотофизических и фотохимических реакций.
Аналогичные аргументы можно высказать теперь и по проблеме «равных доз» при малых P0 и больших временах облучения t, и наоборот [12]. Хотя, формально, одно и то же значение D может набираться в обоих случаях, при уменьшении Р0 порог U > Umin будет достигаться все в меньшем и меньшем объеме тканей (V75, V50 и т. д.), вплоть до ситуации полностью подпорогового облучения тканей U < Umin. В этой ситуации лечебного эффекта уже не будет при любом t. Таким образом, важна и доза D, и мощность (скорость) ее подведения, как для фармпрепарата важны и доза, и частота потребления, что неоднократно, только в других терминах, уже отмечалось многими другими авторами [9][11][12][22][23 и др.]. Это независимые два параметра выбора для персонализации лечебного воздействия при лазерной терапии.
ДОЗА ПРИ ВЛОК
Ну и теперь интересно посмотреть на ситуацию с дозой D при внутривенном лазерном облучении крови (ВЛОК). Теоретическая модельная задача может быть той же самой, но вместо 2-слойной кожи нужно рассмотреть чистую кровь. Не будем учитывать стенки сосуда, т. к. это сильно усложнит задачу, но не привнесет ничего нового, хотя часть ЛИ, например He-Ne лазера, доходит не только до стенок вены, но и можно видеть на фотографиях, как выходит наружу и через эти стенки, и через кожу (рис. 1).
Еще одной особенностью модельной задачи для ВЛОК будет маленькая площадь S. Для оптического волокна диаметром 100 мкм площадь его сечения S ≈ 8 × 10–5 см 2. Типовые рекомендуемые мощности ЛИ на выходе оптического волокна при ВЛОК – порядка 2 мВт [10][12][24]. Это дает P0 = 25 × 10 3 мВт/см 2, что существенно больше, чем при других процедурах, о чем уже говорилось, и интуитивно кажется, что это должно приводить к несоизмеримо большим D. Но одна из особенностей при ВЛОК заключена не сколько в большой P0, сколько в том, что при столь маленькой S нельзя пренебрегать краевыми эффектами и определять эффективную глубину, исходя из цилиндрической формы объема [1]. За счет рассеяния ЛИ внутри крови будет распределено по бокам существенно шире исходной S (рис. 2). А сильное поглощение света кровью приводит к тому, что сам объем поглощения V95 становится очень маленьким по абсолютной величие, и на рисунке его удается наглядно показать только в логарифмической шкале (масштабе), поэтому он кажется большим. Уровень относительного поглощения 0,1, в отличие от расчетов объемов в [1], находится здесь на глубине, существенно меньше 1 мм.
Тем не менее методом Монте-Карло и для данного примера легко смоделировать V95. Однако вычисление zэф здесь более сложно. Как показано в [21], даже при стремлении S к нулю теоретический предел lims→0V95 ≠ 0. Примерная зависимость V95 как функции S приведена на рис. 3. Начиная с каких-то значений S, соотношение V95 = S×zэф справедливо, и функция с большой точностью является линейной: с ростом S наблюдается строгая линейная зависимость V95 от S. Но при малых S, ниже этих значений, V95 уменьшается нелинейно с уменьшением S до некоторого своего предельного значения V95min, не равного нулю, а линейное уравнение перестает работать.
Абсолютная величина V95min зависит, естественно, от оптических свойств крови, но сейчас для нас она не столь важна. В данном конкретном случае оптического волокна диаметром 100 мкм и указанных свойств крови в подписи к рис. 2 мы определили V95 = 0,084 см 3. Если принять контур V95 в таком распределении за полусферу, то zэф можно определить как ее радиус:
 (4)
(4)
В итоге получим zэф = 0,34 см.
И последняя особенность заключена в том, что кровь движется. Это ключевой момент. Скорость движения крови в венах порядка u = 10 см/с. Следовательно, путь, равный zэф = 0,34 см, кровь пройдет за время t* = 3,4 × 10–2 с. Поэтому при вычислении D именно это время необходимо подставить в формулу (3) для вычислений, а остальное время будет облучаться другой объем крови. При плотности крови ρ = 1,05 г/см 3 в подсчитанном объеме V95 облучается 0,088 г крови. Тогда поглощенная доза, определяемая по формуле (3) с t*
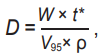 (4)
(4)
составит значение D = 2×0,034/0,088 = 0,77 Гр, что примерно на 3,5 порядка ниже доз при обычной чрескожной низкоинтенсивной терапии (НИЛТ)! Вместо ожидаемой завышенной дозы мы неожиданно получили объективно очень маленькую D. Можно, конечно, говорить, что радиационный коэффициент биологической чувствительности крови kt очень большой, что кровь очень чувствительна к ЛИ и т. д., но 3 порядка настораживают.
На это следует обратить особое внимание, т. к. ВЛОК – наиболее спорная сегодня процедура лазерной терапии, практически не признаваемая в Европе и США в отличие от других лазерных терапевтических процедур3. В [2], в частности, прямо отмечено, что в силу отсутствия воспроизводимых результатов двойных слепых, контролируемых и рандомизированных клинических исследований, российские и китайские методики ВЛОК сомнительны, а механизм их действия до сих пор не ясен. Поскольку механизм лечебного действия ВЛОК не должен кардинально отличаться от обсуждаемых общих механизмов НИЛТ для других тканей, возможно, именно недостаточность и необоснованность дозы ЛИ при ВЛОК не позволяют пока получить устойчивый и воспроизводимый в других странах результат.
Таблица
Сравнение доз D в модельной задаче для разных типовых процедур терапии
Table
Comparison of doses D in a model task for different typical therapeutic procedures
Процедура Procedure | Типовые принятые «дозы» Typical “doses” | Длина волны λ, нм Wavelength | Энергия кванта Quant energy | Оптические свойства Optic properties | Zэф, мм | D, Гр/Gy | |
Эпидермис Epidermis | Дерма Derm | ||||||
УФ-терапия, дерматология UF-therapy, dermatology | P0 = 5 мВт/см 2 H = 480 мДж/см 2 | 315 (УФ) | 3,9 эВ | µa = 100 см-1, µs = 415 см-1, g = 0,7 | µa = 35 см-1; µs = 400 см-1; g = 0,7 | 0,2 | 2,5·10 4 |
ФДТ, онкология PDT, oncology | P0 = 250 мВт/см 2 H = 200 Дж/см 2 | 632 (красн.) red | 2,0 эВ | µa = 3,0 см-1, µs = 200 см-1, g = 0,8 | µa = 1,5 см-1; µs = 150 см-1; g = 0,8 | 3,5 | 6,0·10 5 |
НИЛТ, физиотерапия LLLT physiotherapy | P0 = 15 мВт/см 2 H = 4,0 Дж/см 2 | 810 (ИК) IR | 1,5 эВ | µa = 1,5 см-1, µs = 150 см-1, g = 0,8 | µa = 1,0 см-1; µs = 100 см-1; g = 0,8 | 6,5 | 6.5·10 3 |
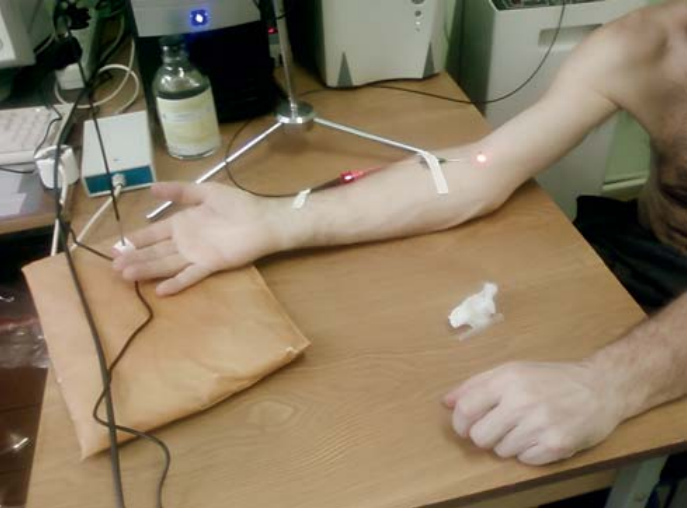
Рис. 1. Процедура ВЛОК с He-Ne лазером
Fig. 1. ILBI (Intravenous Laser Blood Irradiation) with He-Ne laser
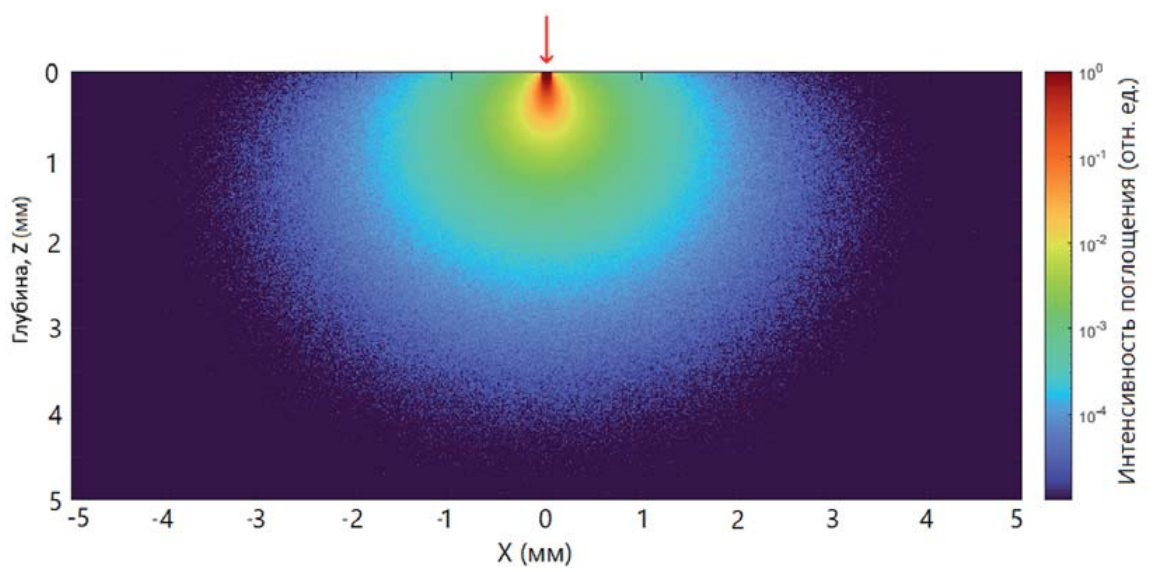
Рис. 2. Облучение крови He-Ne лазером с помощью оптического волокна диаметром 100 мкм. Относительное распределение поглощенной энергии для оптических параметров крови: µa = 2,4 см-1; µs = 885 см-1; g = 0,98. Шкала поглощения логарифмическая
Fig. 2. Irradiation of blood with He-Ne laser light using an optical fiber with diameter 100 microns. Relative distribution of absorbed energy was calculated for optical parameters of blood: µa=2.4 cm-1; µs = 885 cm-1; g = 0,98. Absorption scale is logarithmic
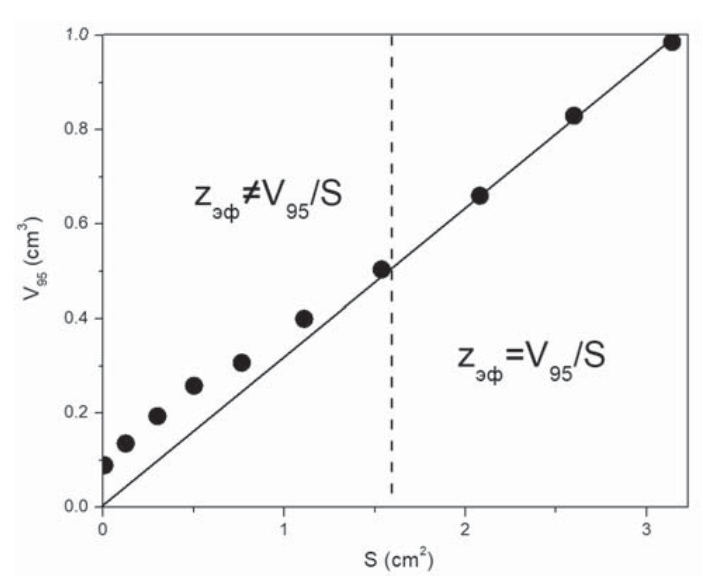
Рис. 3. Зависимость V95 от S для излучения λ = 633 нм в крови
Fig. 3. Dependence of V95 on S for radiation with λ = 633 nm in blood
ОБСУЖДЕНИЕ И ЗАКЛЮЧЕНИЕ
Предложенный подход позволяет немного по-новому и с единых позиций взглянуть на проблему глубины проникновения ЛИ и дозы лазерного воздействия при лечебных и диагностических процедурах. По мнению авторов, он органично и теоретически строго объединяет термины и определения классической клинической дозиметрии и практики лазерной медицины, что ранее в литературе было недостаточно раскрыто. Кроме того, такой подход не вводит в оборот никаких принципиально новых терминов и определений, но позволяет получить более обоснованную с практической точки зрения теоретическую оценку глубины проникновения ЛИ в ткани, а также недоступные ранее сравнительные оценки доз для разных терапевтических процедур. В результате возникает интересный и неожиданный новый ракурс взгляда на проблему.
Можно, конечно, возразить, что здесь использованы лишь частные случаи оптических свойств тканей, µa, µs и g. Безусловно. Но приведенные в статье конкретные числовые значения и примеры и не претендуют на большую точность и единственность возможного. Это, скорее, оценочные и демонстрационные примеры. Точные значения оптических свойств тканей наиболее правильно получать путем их измерений индивидуально у пациента перед назначением процедур. Но такие измерения требуют разработки стандартизованной методики измерений и метрологически аттестованной аппаратуры. Пока здесь приведены лишь правдоподобные ситуации с определенной долей погрешности. Далее результаты могут уточняться и дополняться.
Вместе с тем клинические рекомендации по дозам воздействия содержат большие диапазоны доз ЛИ, оставляя внутри диапазонов врачу выбор для персонализации лечебного воздействия. Пока такие диапазоны достаточно велики, отсутствие индивидуальных данных по, µa, µs и g и погрешности приведенных оценок не представляются существенными. Возможно, конечно, что измерение индивидуальных оптических свойств и оценка по ним дозы D – более обоснованный путь. Однако ряд параметров, таких как плотность крови и кожи, коэффициент поглощения света гемоглобином крови в разных спектральных диапазонах и т. п. от пациента к пациенту меняются настолько незначительно, в пределах нескольких процентов, что этими вариациями явно можно пренебречь. Не исключено, что объем и масса облучаемых тканей для каждой длины волны и каждой из типовых терапевтических процедур имеют на самом деле лишь весьма слабо выраженную индивидуальность, если только нет явных уплотнений в тканях (новообразований), нет выраженной пигментации (фототип выше типа II) и т. д. Поэтому объем облучения, наиболее вероятно, больше зависит от площади облучения S, которая, скажем, для накожных процедур не является параметром выбора, а зависит от размеров очага патологии. В таком случае варьировать врачу все равно остается лишь величинами P0 и t, как это и происходит обычно сегодня в практике лазерной терапии, пусть и без учета µa, µs и g.
Дополнительно, произведение P0 и t определяет энергетическую экспозицию H – не зависимую от объекта на выбранной длине волны λ характеристику воздействия, которую можно измерить. Сам выбор конкретных значений S и H определяется, естественно, индивидуальным состоянием человека, его оптическими свойствами и заболеванием. Но для метрологического контроля H сам объект не нужен в отличие от контроля D. Ее (энергетическую экспозицию) легко измерить. Поэтому H вполне можно именовать экспозиционной дозой. Это ничему не противоречит в медицинской физике. Более того, в радиационной дозиметрии тоже есть понятие экспозиционной дозы [3][4][6]. Там она определяется несколько по-другому, через заряд образующихся ионов воздуха при прохождении через воздух ионизирующего излучения, но она также призвана характеризовать само воздействие без привязки к объекту и измеряется независимо от объекта. Поэтому с точностью до смыслового содержания и профессионального жаргона не будет большой терминологической ошибкой именовать в лазерной медицине H экспозиционной дозой. А вот P0 правильнее именовать освещенностью, мощностью H или скоростью нарастания H, но не дозой, т. к. в дозовых характеристиках «работает» время.
Подводя итог, можно сформулировать следующие выводы.
- В практике лазерной медицины более обосновано под глубиной проникновения понимать величину, определяемую значимым с точки зрения воздействия объемом V%.
- Стандартная в радиобиологии поглощенная доза D c размерностью Дж/кг (Гр) может быть легко определена и для ЛИ, если известны оптические свойства тканей и площадь облучения S.
- Сравнительные данные по Dдля разных накожных терапевтических процедур не противоречат известным клиническим и медико-физическим данным и более контрастно отражают соотношение разных доз для разных целей терапии.
- При ВЛОК наблюдаются поглощенные дозы D, существенно меньшие, на несколько порядков, поглощенных доз при других процедурах терапии. Это настораживает и обращает на себя внимание.
1 Обе величины (частота и скорость) имеют одинаковую смысловую размерность «что-то в единицу времени». В этом их значении они эквивалентны.
2 С точки зрения теории размерностей умножение размерной величины (Гр) на безразмерный коэффициент не может изменить размерность этой величины. Но на это внимание в теории не акцентируется.
3 В свое время на вопрос, почему же в России, Китае и ряде других стран Азии ВЛОК находит широкое применение, довелось услышать такой ответ от французских врачей: «Эффект восточных стран».
Список литературы
1. Рогаткин Д.А., Тарасов А.П., Штыфлюк М.Е. Методические замечания о физических параметрах низкоинтенсивного лазерного воздействия. Часть 1. Глубина проникновения лазерного излучения. Лазерная медицина. 2023; 27 (4): 8–15. https://doi.org/10.37895/2071-8004-2023-27-4-8-15
2. Chung H., Dai T., Sharma S.K. et al. The nuts and bolts of low-level laser (light) therapy. Ann Biomed Eng. 2012; 40 (2): 516–533.
3. Близнюк У.А., Лыкова Е.Н. Клиническая дозиметрия: Учеб. пособие. – М.: ООП физического факультета МГУ. 2019: 45 c.
4. Климанов В.А., Крамер-Агеев Е.А., Смирнов В.В. Радиационная дозиметрия. Монография // Под ред. В.А. Климанова. М.: НИЯУ МИФИ. 2014: 648 c.
5. Жорина Л.В., Змиевской Г.Н. Основы взаимодействия физических полей с биологическими объектами: Воздействие ионизирующего и оптического излучения: Учебное пособие // Под ред. С.И. Щукина. – М.: МГТУ им. Н.Э. Баумана, 2006: 191–206.
6. Завадовская В.Д., Куражов А.П., Пыжова И.Б. Лучевая терапия: учебное пособие. – Томск: СибГМУ. 2013: 104 с.
7. Залесская Г.А. Эффективность фотомодификации крови терапевтическими дозами оптического излучения различных длин волн. Биофизика. 2017; 62 (3): 604–613.
8. Kim M.M. et al. On the in vivo photochemical rate parameters for PDT reactive oxygen species modeling. Phys. Med. Biol. 2017; 62 (5): R1–R48.
9. Москвин С.В. Основы лазерной терапии. Серия «Эффективная лазерная терапия». – М. – Тверь: ООО «Издательство «Триада», 2016; 1: 30–235.
10. Дуплик А.Ю. Дозиметрия низкоинтенсивного лазерного облучения крови. Laser Market. 199; 2–3: 18–20.
11. Дунаев А.В., Евстигнеев А.Р., Шалобаев Е.В. Лазерные терапевтические устройства // Под ред. К.В. Подмастерьева: Учебное пособие. – Орел: ОрелГТУ, 2005: 15–25.
12. Москвин С.В. О некоторых заблуждениях, мешающих развитию лазерной терапии. Уральский медицинский журнал. 2013; 1: 119–121.
13. Дёмин В.В., Половцев И.Г. Фотометрия и ее применения. Учебное пособие. – Томск, изд-во ТГУ, 2017: 344 c.
14. Физический энциклопедический словарь // Под ред. акад. А.М. Прохорова. – М.: Сов. энциклопедия, 1984.
15. Рогаткин Д.А. Биодозиметрический винегрет или история восприятия одной публикации в «Л-И» // Информационный бюллетень Лазерной ассоциации «Лазер-Информ». 2008; 23 (398): 14–16.
16. Асимов М.М. и др. Оценка терапевтического действия низкоинтенсивного лазерного излучения по величине локального насыщения ткани кислородом. Журнал прикладной спектроскопии. 2006; 73 (4): 516–520.
17. Kana J.S. et al. Effect of low-power density laser radiation on healing of open skin wounds in rats. Arch. Surg.1984; 116: 293–296.
18. Abergel R.A. et al. Biostimulation of wound healing by lasers: experimental approaches in animal models and in fibroblast cultures. J. Dermatol. Surg. Oncol. 1987; 13: 127–133.
19. Александров М.Т. Методы клинической биофотометрии. / В кн. Применение низкоинтенсивных лазеров в клинической практике // Под. ред. чл.-корр. РАМН О.К. Скобелкина. – М.: Изд-во «Полиграф-информ», 1997: 265–274.
20. Salomatina E.V. et al. Optical properties of normal and cancerous human skin in the visible and near-infrared spectral range. J. Biomed. Opt. 2006; 11 (6): 064026.
21. Tarasov A.P., Shtyflyuk M.E., Rogatkin D.A. Theoretical substantiation of the possibility of performing non-damaging UV diagnostics of biological tissues in vivo. Photonics. 2023; 10: 1289.
22. Поддубная О.А. Низкоинтенсивная лазеротерапия в клинической практике (Часть 1). Вестник восстановительной медицины. 2020; 6 (100): 92–99.
23. Загускин С.Л. Лазерная терапия – мифы и реальность, возможные пути развития. Информационный бюллетень Лазерной ассоциации «Лазер-Информ». 1999; 2 (161): 1–6.
24. Гейниц А.В., Москвин С.В., Ачилов А.А. Внутривенное лазерное облучение крови – М. – Тверь: ООО «Издательство «Триада», 2012: 32 c.
Об авторах
Д. А. РогаткинРоссия
Рогаткин Дмитрий Алексеевич – доктор технических наук, заведующий лабораторией медико-физических исследований
Москва
А. П. Тарасов
Россия
Тарасов Андрей Петрович – кандидат физико-математических наук,, научный
сотрудник лаборатории медико-физических исследований
Москва
М. Е. Штыфлюк
Россия
Штыфлюк Мария Евгеньевна – младший научный сотрудник лаборатории
медико-физических исследований
Москва
Рецензия
Для цитирования:
Рогаткин Д.А., Тарасов А.П., Штыфлюк М.Е. Методические замечания о физических параметрах низкоинтенсивного лазерного воздействия. Часть 2. Доза при процедурах лазерной терапии. Лазерная медицина. 2024;28(1):8-16. https://doi.org/10.37895/2071-8004-2024-28-1-8-16
For citation:
Rogatkin D.A., Tarasov A.P., Shtyflyuk M.E. Methodological notes on physical parameters of low-level laser irradiation. Part 2. Light dosage at laser therapeutic sessions. Laser Medicine. 2024;28(1):8-16. (In Russ.) https://doi.org/10.37895/2071-8004-2024-28-1-8-16
JATS XML


























