Перейти к:
Возрастные особенности морфофункциональных изменений тучных клеток щитовидной железы при низкоинтенсивном лазерном облучении (экспериментальное исследование)
https://doi.org/10.37895/2071-8004-2022-26-3-4-68-74
Аннотация
Цель исследования: изучение динамики морфофункциональных показателей тучных клеток щитовидной железы при низкоинтенсивном лазерном облучении в зависимости от возраста.
Материалы и методы. Эксперимент проведен на 96 белых лабораторных крысах-самцах породы Вистар. Животные были разделены на 4 группы: 1-я – контрольные молодые, 2-я – контрольные старые, 3-я – молодые с применением низкоинтенсивного лазерного излучения, 4-я – старые с применением низкоинтенсивного лазерного излучения. В зоне проекции щитовидной железы осуществлялось однократное лазерное воздействие в непрерывном режиме, длиной волны 970 нм, мощностью 1 Вт, экспозицией 60 с. Выведение животных из эксперимента проводили через 1 час, на 1-е, 3-и и 7-е сутки после лазерного воздействия. Препараты щитовидной железы фиксировали в формалине, готовили гистологические срезы, окрашивали толуидиновым синим, проводили морфометрический анализ с определением количества тучных клеток щитовидной железы и их разновидностей по уровню гранулярного насыщения и степени дегрануляции.
Результаты. Особенности реакции тучных клеток щитовидной железы молодых животных на лазерное воздействие проявлялись в повышении количества клеток, их синтетической активности с увеличением уровня гранулярного насыщения и снижением дегрануляции, что свидетельствует об усилении миграции клеток в щитовидную железу и выраженной адаптивной реакции всей популяции тучных клеток организма. У старых животных лазерное воздействие приводило к увеличению дегрануляционной активности тучных клеток щитовидной железы со снижением уровня гранулярного насыщения. Отсутствие изменения количества клеток свидетельствует об ограничении реакции пределами органа.
Заключение. Полученные результаты расширяют представления об особенностях реакции тучных клеток на лазерное воздействие и подтверждают необходимость индивидуальной коррекции режимов низкоинтенсивного лазерного облучения в зависимости от возраста.
Для цитирования:
Пешкова Д.А., Головнева Е.С., Солянникова Д.Р. Возрастные особенности морфофункциональных изменений тучных клеток щитовидной железы при низкоинтенсивном лазерном облучении (экспериментальное исследование). Лазерная медицина. 2022;26(3-4):68-74. https://doi.org/10.37895/2071-8004-2022-26-3-4-68-74
For citation:
Peshkova D.A., Golovneva E.S., Solyannikova D.R. Age-related morphofunctional changes of thyroid mast cells under low-intensity laser irradiation (an experimental study). Laser Medicine. 2022;26(3-4):68-74. (In Russ.) https://doi.org/10.37895/2071-8004-2022-26-3-4-68-74
ВВЕДЕНИЕ
Низкоинтенсивное лазерное излучение (НИЛИ) в последнее время зарекомендовало себя как эффективный метод терапии, приводящий к активации жизненно важных процессов в организме. Лазерное воздействие стимулирует регенерацию, микроциркуляцию и активирует метаболизм [1]. Щитовидная железа доступна для прямого лазерного воздействия. НИЛИ способно увеличивать функциональную активность органа и повышать уровень секреции гормонов, что с успехом применяется при лечении гипотиреозов различного генеза [2][3]. Однако остается вопрос, будет ли эффективным лазерное воздействие в старческом возрасте, когда происходят морфологические и функциональные изменения паренхимы и стромы щитовидной железы, которые приводят к постепенной утрате способности поддерживать гомеостаз органа [4][5]. Важной составляющей ткани щитовидной железы являются тучные клетки (ТК), которые способны незамедлительно реагировать на любые экзогенные и эндогенные воздействия путем дегрануляции. Тучные клетки активно участвуют в паракринной регуляции благодаря синтезу и выделению широкого спектра медиаторов, таких как гепарин, серотонин, гистамин, факторы роста, цитокины. Эти компоненты гранул способны влиять как на фолликулярный аппарат щитовидной железы, так и на ее стромальную составляющую, в частности, на фибробласты [6]. Тучные клетки являются ведущим регулятором сосудистой проницаемости и ангиогенеза [7], могут воздействовать на процессы образования, накопления, активации и секреции тиреоидных гормонов [8][9]. Известно, что популяция ТК в процессе онтогенеза меняет свои морфологические и функциональные характеристики, связанные со способностью мигрировать, синтезировать гранулы и выделять их за пределы клетки [4][5], поэтому при комплексном исследовании важно рассматривать такие характеристики ТК, как их количество, степень гранулярного насыщения и индекс дегрануляции. Возрастные особенности реакции тучных клеток щитовидной железы в ответ на лазерное воздействие ранее не изучались.
Цель исследования: изучение динамики морфофункциональных показателей тучных клеток щитовидной железы при НИЛИ в зависимости от возраста.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперимент был проведен на 96 белых лабораторных крысах-самцах породы Вистар двух возрастных групп: молодые половозрелые животные (возраст – 1,5–2 месяца, вес – 100–130 г) и старые животные (возраст – 1,5–2 года, вес – 280–315 г) [10]. Животные содержались в условиях вивария. Ежедневный рацион включал в себя специализированный корм для лабораторных животных со свободным доступом к воде. Условия работы с животными соответствовали международным и российским нормам биоэтики. Животные были разделены на 4 группы: 1-я группа – контрольные молодые животные, 2-я – контрольные животные старческого возраста, 3-я – молодые животные с лазерным воздействием на щитовидную железу, 4-я группа – животные старческого возраста с лазерным воздействием на щитовидную железу.
Экспериментальные животные подвергались однократному лазерному воздействию на область локализации щитовидной железы. Для проведения НИЛИ применялся аппарат «ИРЭ-Полюс» (Россия) с кварцевым световодом, расстояние до поверхности кожи – 0,5 см, диаметр светового пятна – 1,0 см, в непрерывном режиме излучения с длиной волны 970 нм, плотностью мощности 1 Вт/см 2, экспозицией 60 с. Манипуляции проводились с использованием общей анестезии препаратом «Золетил 100» («Vibram», Франция), действующие вещества: тилетамина гидрохлорид и золазепама гидрохлорид, внутримышечное введение в дозе 5 мг/кг. Выведение животных из эксперимента осуществлялось через 1 час, на 1-е, 3-и и 7-е сутки. Умерщвление осуществляли передозировкой эфирным наркозом до прекращения дыхания и сердцебиения.
Выделенную ткань щитовидной железы фиксировали в 10%-ном нейтральном забуференном формалине. После стандартной гистологической проводки и приготовления парафиновых блоков были изготовлены серийные гистологические срезы органа толщиной 5 мкм, которые окрашивались толуидиновым синим («BioVitrum», Россия) для визуализации ТК. Гистологические препараты изучали с помощью микроскопа «LEICA DMRXA» (Германия) и цифровой видеокамеры «LEICA DFC 290» (Германия), сопряженной с персональным компьютером. Для морфометрических исследований использовали программу анализа изображений «ImageScope М» (Россия). Подсчет ТК щитовидной железы осуществлялся на всем срезе органа при увеличении ×400 (окуляр ×10, объектив ×40), затем подсчитывалось количество ТК на условную площадь среза – 1,82 мм 2.
Степень гранулярного насыщения рассчитывали по вычислению среднего гистохимического коэффициента (СГК):
СГК = (1 × А + 2 × Б + 3 × В + Г × 0)/n,
где 1, 2, 3, 4 – степени гранулярного насыщения; А, Б, В, Г – число клеток соответственно: очень темные, темные, светлые и очень светлые, n – число всех ТК.
Для оценки степени дегрануляции популяции ТК вычисляли индекс дегрануляции (ИД) по формуле:
ИД = (А × 0 + Б × 1 + В × 2 + Г × 3)/n,
где А – неактивные ТК, Б – слабо дегранулирующие ТК, В – умеренно дегранулирующие ТК, Г – сильно дегранулирующие ТК, n – суммарное количество проанализированных ТК [11].
Обработка полученных данных осуществлялась методом вариационной статистики, при этом данные выражались в виде медианы, верхнего и нижнего квартилей – Ме [Q1; Q3]. Для оценки достоверности использовали непараметрический метод (коэффициент Манна – Уитни), статистически значимыми считали различия при р < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Количество ТК в препаратах щитовидной железы у контрольных групп молодых и старых животных достоверно не отличалось. Через 1 час после лазерного воздействия на щитовидную железу молодых животных происходило уменьшение количества ТК (рис. 1), что могло быть связано с интенсивной дегрануляцией и последующим полным опустошением клеток. Однако на 3-и и 7-е сутки наблюдалось достоверное увеличение количества ТК (рис. 2). Этот эффект мог быть вызван активной миграцией ТК в строму щитовидной железы молодых животных, так как именно приток предшественников ТК из костного мозга обеспечивает прирост тканевой популяции в период постнатального развития [12]. У старых животных после НИЛИ уменьшение количества ТК было сравнительно небольшим и достоверно проявилось только на 3-и сутки эксперимента. На 7-е сутки происходило возвращение количества ТК к показателям контроля. Количество ТК на 1-е, 3-и и 7-е сутки после лазерного воздействия у молодых животных было достоверно выше, чем у старых животных.
Степень гранулярного насыщения отражает первый этап секреторного цикла ТК – синтез биологически активных веществ, создающих характерную метахромазию при окрашивании толуидиновым синим. После лазерного воздействия в группе молодых животных через 1 час наблюдалось достоверное снижение гранулярного насыщения, причиной которого могла стать активная дегрануляция, которая была вызвана лазерным воздействием. На 1-е сутки произошло восстановление содержания гранул в тучных клетках, на 3-и и 7-е – увеличение степени гранулярного насыщения, что свидетельствовало об интенсивных процессах синтеза и уменьшении дегрануляции.
У старых животных через 1 час и на 1-е сутки после лазерного воздействия гранулярное насыщение ТК не изменялась, но на 3-и сутки наблюдалось достоверное уменьшение содержания гранул в клетках как свидетельство перехода ТК в более активное функциональное состояние. Однако на 7-е сутки происходила стабилизация показателя с возвращением к значениям контроля. На сроках 1, 3 и 7 суток после лазерного воздействия показатель гранулярного насыщения ТК у молодых животных был значимо выше, чем у старых животных (рис. 3).
Дегрануляция ТК является маркером лазерного воздействия. Есть данные, что лазерное излучение вызывает активацию Ca 2+-зависимых процессов, к которым относится экзоцитоз гранул ТК [7]. Поэтому важно оценивать интенсивность дегрануляции, что отражает второй этап секреторного цикла ТК – выделение биологически активных веществ. У молодых животных через 1 час после лазерного воздействия наблюдалось достоверное увеличение индекса дегрануляции ТК, что совпадало по срокам с уменьшением количества клеток и снижением гранулярного насыщения и являлось следствием незамедлительной активации популяции ТК. На 1-е сутки индекс дегрануляции стабилизировался и оставался на уровне контроля вплоть до 7-х суток, что объясняет увеличение гранулярного коэффициента и стабильное количество ТК, так как клетки перешли в состояние накопления гранулярного содержимого. ТК щитовидной железы старых животных характеризовались более интенсивной и длительной дегрануляцией в ответ на лазерное воздействие. Хотя усиление дегрануляции начиналось несколько позднее, чем в группе молодых животных (с 1-х суток), на 3-и сутки эксперимента наблюдалось увеличение индекса дегрануляции в 2 раза, что нашло отражение в уменьшении количества клеток и их гранулярного насыщения. На 7-е сутки после лазерного воздействия происходило возвращение индекса дегрануляции к показателям контроля (рис. 4).
Таким образом, особенности лазерного воздействия на ТК щитовидной железы проявлялись в зависимости от возраста экспериментальных животных. У молодых животных дегрануляция с уменьшением количества клеток и гранулярного насыщения отмечалась непосредственно (через 1 час) после лазерного воздействия. В последующие сроки наблюдалась тенденция к увеличению количества ТК, то есть происходила миграция ТК в ткани щитовидной железы, при этом процессы синтеза и дегрануляции быстро возвращались в устойчивое равновесие. Это свидетельствует об успешно работающих адаптивных механизмах всей популяции ТК и адекватном ответе нейроиммуноэндокринной системы молодых животных в ответ на лазерное воздействие. У старых животных после лазерного воздействия изменений количества ТК не отмечалось, однако происходило уменьшение гранулярного насыщения в связи с активной дегрануляцией на 1-е и 3-и сутки эксперимента (рис. 5). На 7-е сутки все показатели стабилизировались. Данные факты указывали на замедленную и продолжительную активацию собственных ТК стромального компонента щитовидной железы старых животных без генерализации реакции. В литературе отсутствуют данные об особенностях реакции ТК старых животных на лазерное воздействие. Относительно морфофункциональных особенностей популяции ТК у старых животных имеются данные о возрастании количества ТК, снижении их насыщенности гранулами на фоне резкого увеличения функциональной активности [4][5], то есть отставании процессов синтеза от дегрануляции.
В представленном исследовании было использовано однократное непрерывное инфракрасное лазерное воздействие. С учетом полученных данных можно сделать вывод о необходимости коррекции кратности лазерного воздействия у особей старческого возраста. Ранее было показано, что ответные реакции популяции тучных клеток больше выражены при повышении курсовой дозы лазерной энергии, поэтому необходимо увеличить количество проводимых сеансов лазерной терапии для получения максимального эффекта [7]. Тучные клетки являются важным, но не единственным компонентом местной регуляции гормонального статуса организма, поэтому их особенности важно учитывать в комплексном анализе состояния сосудистого русла щитовидной железы и фолликулярного эпителия.
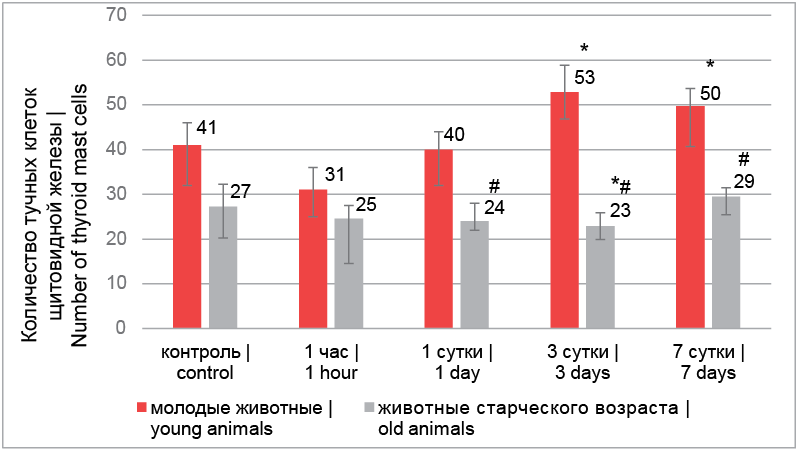
Рис. 1. Количество тучных клеток щитовидной железы экспериментальных животных (на единице условной площади – 1,82 мм 2): * – достоверные различия с контролем (р < 0,05), # – достоверные различия внутри срока (р < 0,05)
Fig. 1. Number of mast cells of the thyroid gland in experimental animals (per unit of conditional area – 1,82 mm 2): * – significant differences with control (p < 0.05), # – significant differences within the term (p < 0.05)
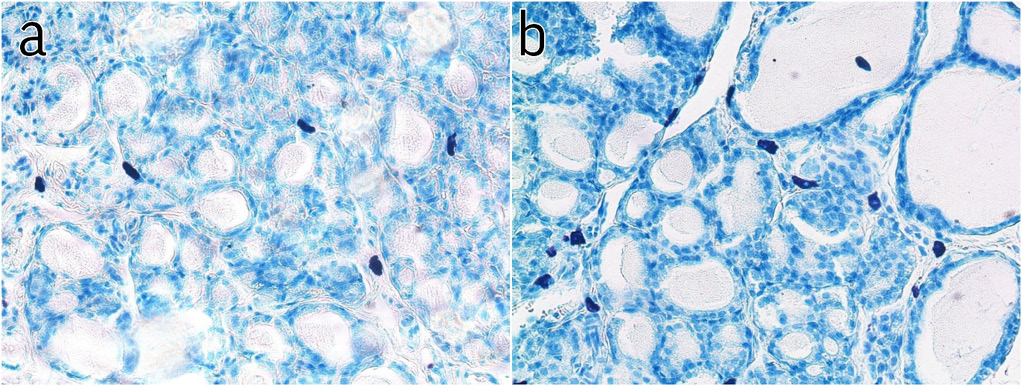
Рис. 2. Щитовидная железа молодого животного: a – небольшое количество тучных клеток в поле зрения (контрольная группа), b – увеличение количества тучных клеток на 3-и сутки после лазерного воздействия. Микрофотография. Окраска: толуидиновый синий. Ув. ×400 (ок. ×10, об. ×40)
Fig. 2. Young animal thyroid: a – a small number of mast cells in the visual field (control group), b – increasing the number of mast cells by day 3 after laser exposure. Micrograph. Staining: toluidine blue. Magnification ×400
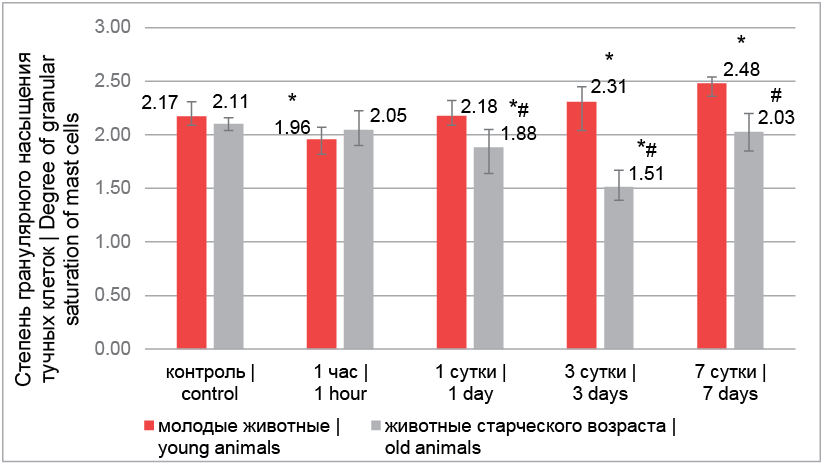
Рис. 3. Степень гранулярного насыщения тучных клеток щитовидной железы экспериментальных животных: * – достоверные различия с контролем (р < 0,05), # – достоверные различия внутри срока (р < 0,05)
Fig. 3. Degree of granular saturation of thyroid mast cells in experimental animals: * – significant differences with control (p < 0.05), # – significant differences within the term (p < 0.05)
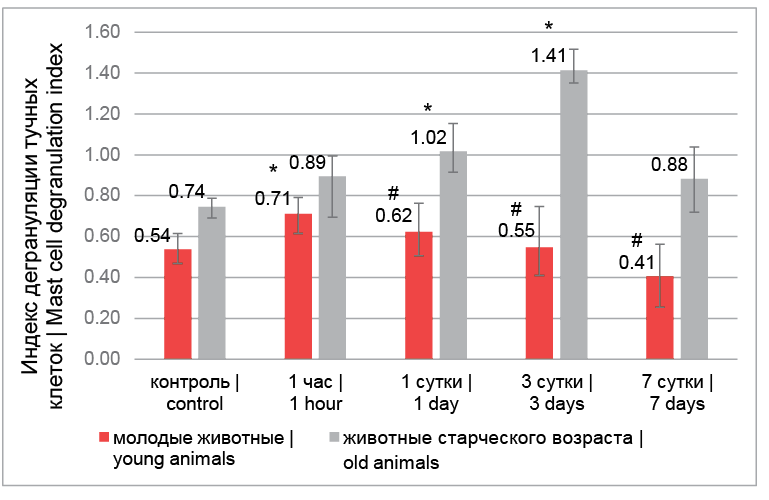
Рис. 4. Индекс дегрануляции тучных клеток щитовидной железы экспериментальных животных: * – достоверные различия с контролем (р < 0,05), # – достоверные различия внутри срока (р < 0,05)
Fig. 4. Index of thyroid mast cell degranulation of experimental animals: * – significant differences with control (p < 0.05), # – significant differences within the term (p < 0.05)
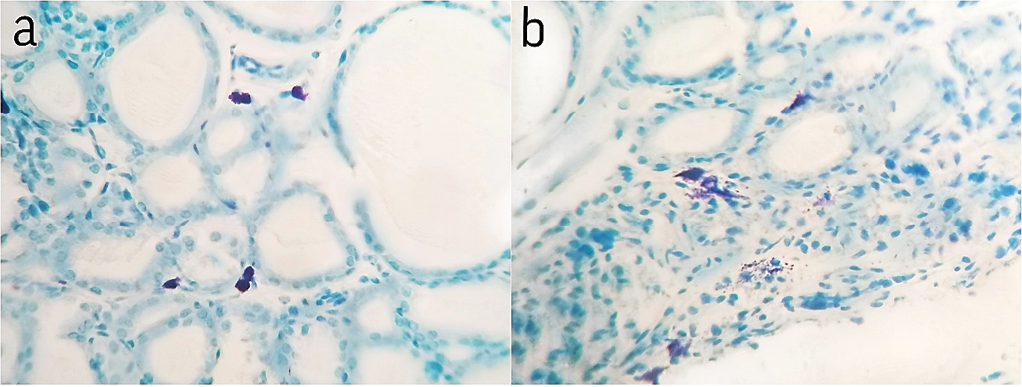
Рис. 5. Щитовидная железа животного старческого возраста: а – контрольная группа с преобладанием тучных клеток без признаков дегрануляциии, b – на 3-и сутки после лазерного воздействия с преобладанием умеренной и сильной степени дегрануляции. Микрофотография. Окраска: толуидиновый синий. Ув. ×400 (ок. ×10, об. ×40)
Fig. 5. Thyroid gland of an old animal: a – control group with predominant mast cells with no signs of degranulation, b – on day 3 after laser exposure, degranulation is mostly from moderate to severe. Micrograph. Staining: toluidine blue. Magnification ×400
ЗАКЛЮЧЕНИЕ
Морфофункциональные особенности реакции тучных клеток щитовидной железы молодых животных на лазерное воздействие проявляются повышением их количества с увеличением уровня гранулярного насыщения и снижением индекса дегрануляции. У старых животных лазерное воздействие приводит к увеличению дегрануляционной активности тучных клеток со снижением уровня гранулярного насыщения. Полученные результаты не только расширяют представления о возрастных особенностях реакции тучных клеток на лазерное воздействие, но и подтверждают необходимость индивидуальной коррекции режимов лазерного воздействия в зависимости от возраста.
Список литературы
1. Москвин С.В., Кочетков А.В. Эффективные методики лазерной терапии. Тверь: Триада; 2016.
2. Höfling D.B., Chavantes M.C., Buchpiguel C.A., et al. Safety and efficacy of low-level laser therapy in autoimmune thyroiditis: Long-term follow-up study. Int J Endocrinol. 2018; 2018: 8387530. DOI: 10.1155/2018/8387530
3. Ercetin C., Sahbaz N.A., Acar S., et al. Impact of photobiomodulation on T3/T4 ratio and quality of life in Hashimoto thyroiditis. Photobiomodul Photomed Laser Surg. 2020; 38 (7): 409–412. DOI: 10.1089/photob.2019.4740
4. Бегманов С.А., Ибрагимова Х.О., Исмоилов Б.Б., Гаппаров К.С. Возрастные особенности количества тканевых тучных клеток морских свинок при аллергических реакциях анафилактического и гистаминового типа. Молодой ученый. 2016; 10 (114): 470–473.
5. Козлов А.А. Возрастные изменения тучноклеточной популяции вилочковой железы у крыс. Вестник Челябинского государственного университета. 2013; 7 (298): 147–148.
6. Кутукова Н.А., Назаров П.Г. Tучные клетки: роль в воспалении, восстановлении тканей и развитии фиброза. Цитокины и воспаление. 2014; 13 (2): 11–20.
7. Смелова И.В., Головнева Е.С. Динамика функциональной активности тиреоцитов при изменении морфофункционального состояния тучных клеток щитовидной железы под воздействием инфракрасного лазерного излучения. Вестник Российского государственного медицинского университета. 2016; 6: 39–44.
8. Landucci E., Laurino A., Cinci L., et al. Thyroid hormone, thyroid hormone metabolites and mast cells: A less explored issue. Front Cell Neurosci. 2019; 13: 79. DOI: 10.3389/ fncel.2019.00079
9. Chieffi Baccari G., Falvo S., Lanni A., et al. Mast cell population and histamine content in hypothyroid rat tissues. Animals (Basel). 2022; 12 (14): 1840. DOI: 10.3390/ ani12141840
10. Западнюк И.П., Западнюк В.И., Захария Е.А., Западнюк Б.В. Лабораторные животные. Разведение, содержание, использование в эксперименте. 3-е изд., перераб. и доп. Киев: Вища школа. Головное изд-во; 1983.
11. Линднер Д.П., Поберий И.А., Розкин М.Я. Морфометрический анализ популяций тучных клеток. Архив патологии. 1980; 42 (6): 60–64.
12. Norrby K. Do mast cells contribute to the continued survival of vertebrates? APMIS. 2022; 130 (10): 618–624. DOI: 10.1111/apm.13264
Об авторах
Д. А. ПешковаРоссия
Пешкова Дарья Андреевна – младший научный сотрудник отдела поисковых исследований
Челябинск
Е. С. Головнева
Россия
Головнева Елена Станиславовна – доктор медицинских наук, профессор кафедры нормальной физиологии им. академика Ю.М. Захарова; заместитель директора по научно-исследовательской работе
Челябинск
Д. Р. Солянникова
Россия
Солянникова Дарья Рашидовна – кандидат биологических наук, доцент кафедры гистологии, эмбриологии и цитологии
Рецензия
Для цитирования:
Пешкова Д.А., Головнева Е.С., Солянникова Д.Р. Возрастные особенности морфофункциональных изменений тучных клеток щитовидной железы при низкоинтенсивном лазерном облучении (экспериментальное исследование). Лазерная медицина. 2022;26(3-4):68-74. https://doi.org/10.37895/2071-8004-2022-26-3-4-68-74
For citation:
Peshkova D.A., Golovneva E.S., Solyannikova D.R. Age-related morphofunctional changes of thyroid mast cells under low-intensity laser irradiation (an experimental study). Laser Medicine. 2022;26(3-4):68-74. (In Russ.) https://doi.org/10.37895/2071-8004-2022-26-3-4-68-74
JATS XML


























