Перейти к:
Эффективность применения лазеротерапии у больных диабетической стопой
https://doi.org/10.37895/2071-8004-2022-26-3-4-26-31
Аннотация
Цель: сравнить эффективность применения лазеротерапии и традиционных методов лечения больных сахарным диабетом с гнойно-некротическим поражением нижних конечностей.
Материалы и методы. В работе представлен ретроспективный анализ результатов лечения 76 больных сахарным диабетом с гнойно-некротическим поражением нижних конечностей. Больные были разделены на две группы. Первую (основную) группу составили 34 пациента, у которых традиционное лечение дополнялось внутривенным лазерным облучением крови и местной лазеротерапией, вторую (контрольную) – 42 пациента, которые получали только традиционное лечение.
Результаты. Лазеротерапия способствовала более быстрому сокращению площади раневого дефекта (17,4 %) по сравнению с традиционными методами лечения (11,1 %), снижала сроки перехода в фазу воспалительно-регенераторных изменений, обеспечивала уменьшение частоты выполнения высокой ампутации нижней конечности с 14 до 6 % и снижение длительности пребывания в стационаре на 11,2 койко-дня.
Заключение. Применение лазеротерапии у больных диабетической стопой ускоряет очищение и сокращение площади раны, позволяет в более короткие сроки, чем при традиционном лечении, уменьшить или ликвидировать воспалительный процесс, стимулирует развитие грануляционной ткани и ускоряет процесс эпителизации.
Для цитирования:
Луценко Ю.Г., Гринцов А.Г., Матийцив А.Б. Эффективность применения лазеротерапии у больных диабетической стопой. Лазерная медицина. 2022;26(3-4):26-31. https://doi.org/10.37895/2071-8004-2022-26-3-4-26-31
For citation:
Lutsenko Yu.G., Grintsov A.G., Matiytsiv A.B. The effectiveness of laser therapy in patients with diabetic foot. Laser Medicine. 2022;26(3-4):26-31. (In Russ.) https://doi.org/10.37895/2071-8004-2022-26-3-4-26-31
ВВЕДЕНИЕ
Согласно прогнозам Международной диабетической федерации, к 2035 г. количество больных сахарным диабетом (СД) в мире увеличится до 592 млн человек. Синдром диабетической стопы (СДС) встречается у 20–80 % пациентов СД в возрасте от 22 до 78 лет [1–6]. Риск ампутации нижних конечностей у больных сахарным диабетом в результате развития гнойно-некротических осложнений СДС в 23 раза выше, чем у здорового человека [3][6]. Около 40–60 % всех выполняемых нетравматических ампутаций производится у больных сахарным диабетом [2–4]. В настоящее время в клинической практике используются различные методы лечения гнойно-некротических осложнений СДС, такие как гипербарическая оксигенация, терапия отрицательным давлением (NPWT, VAC-therapy), применение тканевых факторов роста, лазеротерапия [1][7][8]. Однако процент высоких ампутаций и летальность у данной группы пациентов остаются значимыми [2][5][6][9].
Цель работы: сравнить эффективность применения лазеротерапии и традиционных методов лечения у больных сахарным диабетом с гнойно-некротическим поражением нижних конечностей.
МАТЕРИАЛЫ И МЕТОДЫ
Представлены результаты лечения 76 больных сахарным диабетом с гнойно-некротическим поражением нижних конечностей, находившихся на лечении в хирургическом отделении № 3 ГКБ № 21 г. Донецка в период с 2019 по 2021 г., из которых мужчины составляли 35,5 % (27 чел.), женщины – 64,5 % (49 чел.). Средний возраст больных – 58,7 ± 18,1 года, средняя продолжительность заболевания сахарным диабетом – 9,3 года. Нейропатическая форма СДС отмечена у 21 (27 %) больного, ишемическая – у 14 (18 %), смешанная – у 41 (55 %). Объем поражения тканей стопы варьировал от II до III степени по классификации Wagner (табл. 1).
Пациенты были разделены на две группы. В 1-й (основной) группе из 34 больных традиционное лечение дополнялось внутривенным лазерным облучением крови (ВЛОК) и местной лазеротерапией, во 2-й (контрольной) группе из 42 пациентов применяли только традиционное лечение (дезинтоксикационная, антибактериальная терапия, коррекция углеводного обмена, иммунитета и нарушений гомеостаза, нейрометаболические, вазоактивные, антихолинэстеразные препараты, перевязки с антисептиками и мазями). При поступлении всем больным проводилась хирургическая санация раны с иссечением некротических тканей, дренированием раны, а затем осуществлялось местное лечение под повязкой с учетом фазы раневого процесса. Площадь раневой поверхности составляла от 32 до 618 см 2.
Для ВЛОК применяли аппарат «Лика-терапевт» (Россия), мощностью 2 мВт, длиной волны излучения 632,8 нм в непрерывном режиме. Продолжительность одного сеанса составляла 10–20 мин, количество процедур – 8–10. При местной лазеротерапии выполняли ежедневные сеансы во время перевязок с помощью аппарата «Лика-терапевт». После механической обработки краев раны, промывания и санации раневой полости, излучающие головки устанавливали по краям раны и проводили 7–8 сеансов воздействия низкоинтенсивным лазерным излучением. Продолжительность сеанса облучения составляла от 8 до 15 мин и зависела от размеров раны. Длина волны излучения – 940 нм, мощность – от 6 до 8 Вт в импульсном режиме с частотой 1500 Гц, суммарная доза энергии за сеанс – 0,05–1,0 Дж/см 2.
Для оценки результатов лечения использовали следующие методы.
- Раневая планиметрия. Осмотр ран при перевязке включал измерение их размеров с последующим вычислением площади. Для определения площади раневой поверхности использовалось приложение LesionMeter на операционной системе Android. Измерения проводились на 1-е, 3-и, 5-е и 7-е сутки, вычислялся процент уменьшения площади раневой поверхности за сутки по отношению к предыдущему результату по формуле: As= , где S– величина площади раны при предшествующем измерении, Sn – величина площади раны в настоящий момент, t – количество суток между измерениями.
- Бактериологическое исследование. Определяли качественный состав патогенной микрофлоры, чувствительность к антибиотикам и ее количество в колониеобразующих единицах на 1г ткани раны (КОЕ/г) на 0-е, 1-е, 3-и, 5-е и 7-е сутки.
- Цитологическое исследование. Изучали клеточный состав раневого отделяемого методом мазков-отпечатков, окраска гематоксилином и эозином, увеличение ×400.
Полученные результаты статистически обработаны с определением средней арифметической величины (М), средней квадратичной (SD). Степень достоверности вычисляли по таблице Стьюдента. Различия считали достоверными при р < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Планиметрические исследования показали, что у всех пациентов отмечалась положительная динамика сокращения раневой поверхности. Однако использование лазеротерапии способствовало более быстрому сокращению площади раневого дефекта – на 17,4 % на 7-е сутки исследования по сравнению с традиционными методами лечения (табл. 2).
Ведущая этиологическая роль в развитии гнойных заболеваниях мягких тканей принадлежала Staphylococcus aureus – 42 случая (55,3 %). Далее, по убывающей: Proteus mirabilis – 17 (22,4 %), Escherichia coli – 8 (10,5 %), Enterobacter cloacae – 7 (9,2 %), Pseudomonas aeruginosa – 2 случая (2,6 %). До начала лечения наблюдалась высокая бактериальная обсемененность раны (10 7–8 КОЕ/г ткани). Уменьшение уровня обсемененности ниже критического (10 5 КОЕ/г) при лазеротерапии достигалось в среднем к 3-м суткам против 7-х суток при традиционных методах лечения. На 7-е сутки после лазеротерапии пациентов с микробной колонизацией не наблюдалось в обеих группах. Таким образом, при лазеротерапии снижение микробной обсемененности происходило быстрее по сравнению с традиционными методами лечения (табл. 3).
Цитологические исследования мазков-отпечатков показали, что процесс очищения ран в обеих группах больных протекал по общепатологическим законам. Во всех группах сохранялись общие фазы клеточных реакций, однако процесс очищения протекал с разной скоростью. В первые 3 суток доминировал некротический (I) тип цитограммы (68 %): большое количество некротических тканей, детрита, превалирование нейтрофилов (92–97 %), большинство из которых находилось в состоянии дегенерации и деструкции; незавершенный и извращенный фагоцитоз (в 80–85 % случаев), отсутствие макрофагов, лимфоцитов и полибластов (рис. 1).
В 32 % отмечался дегенеративно-воспалительный (II) тип цитограммы: наличие некротических тканей, детрита и клеточных обломков, преобладание нейтрофильных лейкоцитов (до 90 %), из которых до 50 % клеток находилось в состоянии дегенерации и деструкции, в 65–80 % незавершенный и извращенный фагоцитоз, с обильной микрофлорой, расположенной внутри- и внеклеточно и почти полным отсутствием макрофагов, лимфоцитов и полибластов.
Уменьшение количества некротических тканей, детрита, клеточных обломков, нейтрофильной инфильтрации, появление и увеличение числа лимфоцитов и моноцитов (до 5–10 % клеток в поле зрения), наличие незавершенного и извращенного фагоцитоза (в 65–80 %), появление единичных макрофагов и полибластов на 5-е сутки наблюдения свидетельствовали о переходе раневого процесса в фазу воспалительных изменений (III тип цитограммы). При использовании лазеротерапии этот тип цитограммы имел место у 8 %, а при традиционном лечении – у 4,2 % пациентов (рис. 2).
Крайне редкое выявление в мазке-отпечатке некротических тканей и детрита, преобладание нейтрофильных лейкоцитов (до 70–80 %), сохранность нейтрофилов (до 70 %), появление недифференцированных полибластов, фибробластов и лимфоцитов (до 10–20 %), увеличение до 5 % макрофагов, наличие до 15–20 % нейтрофилов в состоянии дегенерации, повышение до 50–60 % завершенного фагоцитоза на 7-е сутки наблюдения свидетельствовали о переходе раневого процесса в фазу воспалительно-регенеративных изменений (IV тип цитограммы). Наиболее выраженно этот процесс наблюдался при применении лазеротерапии (рис. 3).
Таким образом, результаты проведенных цитологических исследований показали, что применение лазеротерапии способствовало снижению в мазках-отпечатках гнойных ран содержания клеток, определяющих острую фазу воспаления (нейтрофилов, лимфоцитов, моноцитов) и рост числа клеток, формирующих репаративные процессы (макрофагов, фибробластов, полибластов). В основной группе полное закрытие трофической язвы отмечено у 7 больных (21 %), у 12 (35 %) наблюдали значительное улучшение (уменьшение размеров язвенного дефекта за счет частичной эпителизации), у 15 (44 %) – незначительное улучшение (исчезновение явлений воспаления, наличие грануляций). В контрольной группе результаты были следующие: 10 % – закрытие и значительное улучшение, 90 % – незначительное улучшение. Сроки госпитализации больных основной группы составили 18 ± 2,3, контрольной – 29,6 ± 2,5 койко-дня.
Необходимо отметить, что у 12 пациентов после лазеротерапии проведены реконструктивные пластические операции с положительным результатом у 9 больных (75 %). Благоприятные результаты применения лазеротерапии указывают на необходимость лазерной предоперационной подготовки больных с нейротрофическими язвами. Применение лазеротерапии позволило сберечь жизнеспособность стопы у больных с гнойно-некротическим процессом в 94 % случаев, при этом некрэктомия была альтернативой высокой ампутации нижней конечности, которая выполнена 2 пациентам. Напротив, у пациентов контрольной группы чаще наблюдались осложнения в виде длительного течения раневого процесса, распространения акральных некрозов, увеличения частоты повторных операций в форме высоких ампутаций нижней конечности. У 6 (14 %) больных этой группы комплексная консервативная терапия была неэффективной, им выполнена высокая ампутация нижней конечности в связи с распространением гнойно-некротического процесса.
Таблица 1
Распределение больных синдромом диабетической стопы по классификации Wagner
Table 1
Distribution of patients with diabetic foot syndrome by Wagner classification
Форма Form | Степень Degree | Всего Total | |
II | III | ||
Нейропатическая Neuropathic | 12 | 9 | 21 |
Ишемическая Ischemic | 8 | 6 | 14 |
Смешанная Mixed | 27 | 14 | 41 |
Всего Total | 47 | 29 | 76 |
% | 62 | 38 | 100 |
Таблица 2
Скорость уменьшения площади раны
Table 2
Rate of reduction of wound area
Сроки наблюдения, сутки Observation period, day | Сокращение площади раневого дефекта, % Reduction of wound area, % | |
1-я группа Group 1 | 2-я группа Group 2 | |
1-е | 6,2 | 4,0 |
3-и | 11,1* | 5,3 |
5-е | 16,3* | 8,8 |
7-е | 17,4* | 11,1 |
Примечание: * – различия достоверны, р < 0,05.
Note: * – differences are significant, р < 0.05.
Таблица 3
Динамика элиминации микробных возбудителей из ткани
Table 3
Dynamics of elimination microbial pathogens from tissue
Группы больных Groups of patients | Сроки наблюдения, сутки Observation period, day | ||||
0 | 1 | 3 | 5 | 7 | |
Степень обсемененности раны (КОЕ/г) Degree of contamination of wound (CFU/g) | |||||
1 | 3,4 × 10 7 | 3,7 × 10 5 | 2,2 × 10 4 | 2,5 × 10 2 | – |
2 | 2,7 × 10 7 | 5,8 × 10 6 | 1,8 × 10 5 | 1,4 × 10 5 | 3,6 × 10 3 |
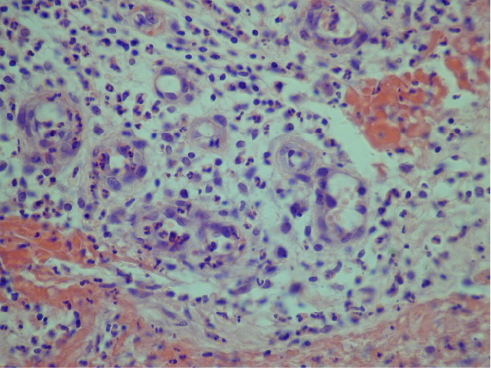
Рис. 1. Нейтрофильная инфильтрация сосочкового слоя дермы. Окраска гематоксилином и эозином, увеличение ×400
Fig. 1. Neutrophil infiltration of the papillary dermis layer. Staining with hematoxylin and eosin, magnification ×400
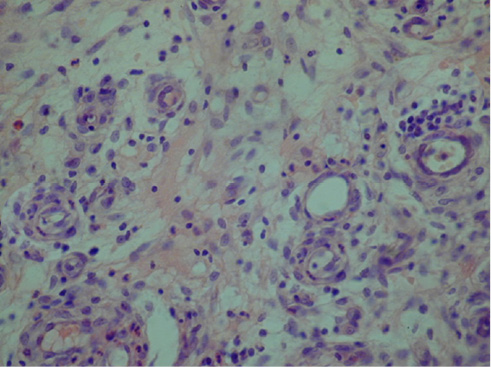
Рис. 2. Рана на 5-е сутки после воздействия лазерного излучения. Единичные нейтрофилы и мелкие группы лимфоцитов в сосочковом слое дермы. Окраска гематоксилином и эозином, увеличение ×400
Fig. 2. Wound on day 5 after exposure to laser irradiation. Single neutrophils and small groups of lymphocytes in the papillary layer of the dermis. Staining with hematoxylin and eosin, magnification ×400
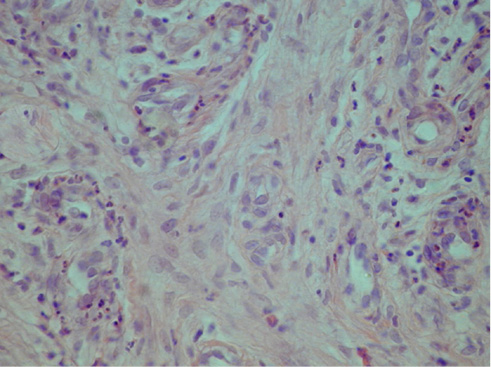
Рис. 3. Рана на 9-е сутки воздействия лазерного излучения. Компактное скопление фибробластов, окруженных тонкими пучками оксифильных коллагеновых волокон. Окраска гематоксилином и эозином, увеличение ×400
Fig. 3. Wound on day 9 after exposure to laser irradiation. Compact cluster of fibroblasts surrounded by thin bundles of oxyphilic collagen fibers. Staining with hematoxylin and eosin, magnification ×400
ЗАКЛЮЧЕНИЕ
Применение лазерного излучения у больных диабетической стопой способствует более быстрому сокращению площади раневого дефекта (17,4 %) в сравнении с традиционным лечением (11,1 %) на 7-е сутки. Использование лазеротерапии в комплексном лечении гнойных ран ускоряет переход в фазу воспалительно-регенеративных изменений. Применение лазерного излучения в лечении гнойно-некротических ран нижних конечностей у больных сахарным диабетом обеспечивает уменьшение частоты выполнения высокой ампутации нижней конечности с 14 до 6 %, сокращение длительности стационарного лечения на 11,2 койко-дня по сравнению с традиционными методами.
Список литературы
1. Баранов А.В., Исмаилов Г.И., Дербенев В.А., Раджабов А.А. Комбинированное применение фотодинамической терапии и гидрохирургических технологий в комплексном лечении обширных гнойных ран у больных синдромом диабетической стопы. Международный научно-практический конгресс «Раны и раневые инфекции», посвященный 140-летию со дня рождения С.С. Гирголава: сборник научных трудов. М.; 2021: 18–21.
2. Галстян Г.Р., Викулова О.К., Исаков М.А. и др. Эпидемиология синдрома диабетической стопы и ампутаций нижних конечностей в Российской Федерации по данным Федерального регистра больных сахарным диабетом (2013–2016 гг.). Сахарный диабет. 2018; 21 (3): 170–177. DOI: 10.14341/DM9688
3. Дедов И.И., Шестакова М.В., Майоров А.Ю. и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. 9-й выпуск. Сахарный диабет. 2019; 22 (1S1): 1–144. DOI: 10.14341/DM221S1
4. Дербенев В.А., Раджабов А.А., Гусейнов А.И., Исмаилов Г.И. Комплексный подход к лечению гнойно-некротических ран при синдроме диабетической стопы. 4-й международный научно-практический конгресс «Раны и раневые инфекции»: сборник научных трудов. М.; 2018: 58–60.
5. Цветков В.О., Колованова О.В., Микаелян Л.С. и др. Остеомиелит диабетической стопы: баланс между радикальным хирургическим лечением и пролонгированной антибиотикотерапией с позиции хирурга. Consilium Medicum. 2020; 22 (4): 61–65. DOI: 10.26442/20751753.2020.4. 200143
6. Armstrong D.G., Boulton A.J.M., Bus S.A. Diabetic foot ulcers and their recurrence. N Engl J Med. 2017; 376 (24): 2367–2375. DOI: 10.1056/NEJMra1615439
7. De Alencar Fonseca Santos J., Campelo M.B.D., de Oliveira R.A., et al. Effects of low-power light therapy on the tissue repair process of chronic wounds in diabetic feet. Photomed Laser Surg. 2018; 36 (6): 298–304. DOI: 10.1089/ pho.2018.4455
8. Saeedi P., Petersohn I., Salpea P., et al. Global and regional diabetes prevalence estimates for 2019 and projections for 2030 and 2045: Results from the International Diabetes Federation Diabetes Atlas, 9th edition. Diabetes Res Clin Pract. 2019. 157: 107843. DOI: 10.1016/j. diabres.2019.107843
9. Milcheski D.A., Portocarrero M.L., Alvarez D.M., et al. Initial experience with negative-pressure wound therapy with instillation in complex wounds. Rev Col Bras Cir. 2017; 44 (4): 348–353. DOI: 10.1590/0100-69912017004008
Об авторах
Ю. Г. ЛуценкоРоссия
Луценко Юрий Григорьевич – кандидат медицинских наук, доцент кафедры хирургии ФИПО
Донецк
А. Г. Гринцов
Россия
Гринцов Александр Григорьевич – доктор медицинских наук, профессор, заведующий кафедрой хирургии ФИПО
Донецк
А. Б. Матийцив
Россия
Матийцив Александр Богданович – кандидат медицинских наук, доцент кафедры хирургии ФИПО
Донецк
Рецензия
Для цитирования:
Луценко Ю.Г., Гринцов А.Г., Матийцив А.Б. Эффективность применения лазеротерапии у больных диабетической стопой. Лазерная медицина. 2022;26(3-4):26-31. https://doi.org/10.37895/2071-8004-2022-26-3-4-26-31
For citation:
Lutsenko Yu.G., Grintsov A.G., Matiytsiv A.B. The effectiveness of laser therapy in patients with diabetic foot. Laser Medicine. 2022;26(3-4):26-31. (In Russ.) https://doi.org/10.37895/2071-8004-2022-26-3-4-26-31



























