Перейти к:
Интраоперационная фотодинамическая терапия в комбинированном лечении саркомы мягких тканей
https://doi.org/10.37895/2071-8004-2022-26-3-4-9-15
Аннотация
Саркома мягких тканей является редким злокачественным новообразованием. Несмотря на усовершенствование хирургической техники и применение комбинированных методов лечения, частота локальных рецидивов этого заболевания остается высокой. Актуальным является поиск альтернативных методов лечения.
Цель: оценить безопасность и эффективность интраоперационной фотодинамической терапии в комбинированном лечении местнораспространенных сарком мягких тканей.
Материалы и методы. В исследование включено 44 пациента саркомой мягких тканей. Больные распределены на три группы. Первая группа (n = 10): саркома мягких тканей стадии Т2-3N0M0G1, хирургическое лечение и интраоперационная фотодинамическая терапия. Вторая группа (n = 17): саркома мягких тканей стадии T2–3N0M0G2–3, хирургическое лечение и интраоперационная фотодинамическая терапия. Третья группа (n = 17): саркома мягких тканей стадии T2-3N0M0-1G2-3, комплексное лечение – предоперационная лучевая терапия, хирургическое лечение, интраоперационная фотодинамическая терапия, неоадъювантная и адъювантная химиотерапия. Для определения степени накопления фотосенсибилизатора в опухолевой ткани проводилась флюоресцентная спектрометрия. Методика лечения: за 2,5–3 часа до операции вводили фотосенсибилизатор, выполняли удаление опухоли с резекцией прилежащих мышц и здоровых тканей, затем проводили лазерное облучение ложа опухоли с помощью аппарата «Латус». Мощность излучения составила до 2,5 Вт, плотность мощности – до 0,28 Вт/см 2, доза облучения – до 100 Дж/см 2. Сроки наблюдения пациентов составили от 14 до 44 месяцев.
Результаты. Спектрометрия показала преимущественное накопление фотосенсибилизатора в ткани опухоли. Реакций на введение фотосенсибилизатора, изменений в ложе опухоли и увеличения сроков заживления раны после интраоперационной фотодинамической терапии не отмечалось. В указанные сроки наблюдения все пациенты были живы. Рецидив заболевания был выявлен у 38,7 % больных: в 1-й группе – у 30 %, во 2-й – у 35,3 %, в 3-й – у 53 %. Из 20 пациентов с первичными новообразованиями диагностированы рецидивы у 30 %. Из 24 пациентов с рецидивными новообразованиями повторные рецидивы выявлены у 45,8 %.
Заключение. Интраоперационная фотодинамическая терапия является безопасным и эффективным методом лечения сарком мягких тканей и перспективным направлением для исследования. Небольшое количество наблюдений, разнообразие гистологических форм и стадий заболевания затрудняет интерпретацию результатов ее эффективности. Методика требует дальнейшего изучения.
Для цитирования:
Ярославцева-Исаева Е.В., Зубарев А.Л., Капинус В.Н., Курильчик А.А., Иванов В.Е., Стародубцев А.Л. Интраоперационная фотодинамическая терапия в комбинированном лечении саркомы мягких тканей. Лазерная медицина. 2022;26(3-4):9-15. https://doi.org/10.37895/2071-8004-2022-26-3-4-9-15
For citation:
Yaroslavtseva-Isaeva E.V., Zubarev A.L., Kapinus V.N., Kurilchik A.A., Ivanov V.E., Starodubtsev A.L. Intraoperative photodynamic therapy in the combined treatment of soft tissue sarcoma. Laser Medicine. 2022;26(3-4):9-15. (In Russ.) https://doi.org/10.37895/2071-8004-2022-26-3-4-9-15
ВВЕДЕНИЕ
Саркома мягких тканей (СМТ) является редким злокачественным новообразованием различной локализации и гистологической структуры [1]. Современная клинико-морфологическая классификация ВОЗ насчитывает более 50 форм СМТ. По данным литературы, СМТ составляет 1 % злокачественных новообразований и чаще всего локализуются на конечностях. Длительное время единственным методом лечения больных СМТ являлся хирургический. Однако хирургическое лечение СМТ в самостоятельном режиме, несмотря на усовершенствование техники операций, не позволяет обеспечить высокие показатели безрецидивной выживаемости, особенно при местнораспространенных опухолях высокой степени злокачественности. Согласно клиническим рекомендациям, лечение СМТ должно быть комбинированным [2][3]. Высокая частота локального рецидивирования и метастазирования, отсутствие четких стандартов применения лучевой терапии и локальной гипертермии, стратификации по морфологии определяют актуальность и заставляют искать новые методики комбинированной терапии [4][5].
Основные причины рецидивов СМТ: отсутствие истинной капсулы, склонность к инфильтративному росту, мультицентричность зачатков, неадекватность хирургического лечения. Проведение курсов системной неоадъювантной и адъювантной химиотерапии, химиоэмболизации увеличивает количество органосохраняющих операций, улучшает показатели локального контроля над опухолью и долгосрочной выживаемости, облегчает основной этап хирургического лечения [6], но не гарантирует идеального результата. К тому же остается группа пожилых пациентов с тяжелыми сопутствующими заболеваниями, которым невозможно применение химиотерапии в полном объеме. Одним из направлений повышения эффективности комбинированного лечения может стать интраоперационная фотодинамическая терапия (ИФДТ) на ложе удаленной опухоли. Методика может увеличить эффективность лечения СМТ за счет повышения уровня абластики, воздействия на оставшиеся жизнеспособные опухолевые клетки и тем самым предотвратить или уменьшить развитие рецидивов.
Фотодинамическая терапия (ФДТ) является локальным методом лечения различных злокачественных новообразований, при котором внутривенно введенный фотосенсибилизатор (ФС) накапливается в опухолевой ткани в большей концентрации, чем в окружающих тканях и активируется после облучения светом с длиной волны, соответствующей длинноволновому пику поглощения ФС. Возникающая в присутствии кислорода тканей фотодинамическая реакция вызывает генерацию синглетного кислорода, который повреждает опухолевые клетки. Действие активных форм кислорода проявляется прямым цитотоксическим повреждением злокачественных клеток и деструкцией питающих опухоль кровеносных сосудов [7–10]. Непосредственным результатом воздействия ФДТ на клетку является некроз. ФДТ стимулирует иммунные реакции организма против опухоли за счет прямого притока лимфоцитов, нейтрофилов и макрофагов в ткани опухоли. Это приводит к замедлению роста опухоли за счет выброса макрофагами фактора некроза опухоли и цитокинов, ответственных за противоопухолевый эффект [11–15].
Имеются публикации об эффективном применении ФДТ с различными ФС в самостоятельном варианте при лечении экспериментальных СМТ малых размеров глубиной до 1,0 см [16–19]. Встречаются единичные публикации об успешном применении ФДТ при СМТ I стадии [20]. В доступной литературе мы не встретили публикаций о применении ФДТ в комбинированном лечении местнораспространенных СМТ. Имеются научные работы о применении ИФДТ в комбинированном лечении рецидивов саркомы забрюшинного пространства, опухолях брюшной полости, рецидивах опухолей малого таза, молочной железы [21–25].
Цель исследования: оценить безопасность и эффективность ИФДТ в комбинированном лечении саркомы мягких тканей.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включено 44 пациента СМТ: 28 женщин и 16 мужчин в возрасте от 20 до 89 лет с марта 2018 г. по сентябрь 2020 г. Распределение больных по клинической стадии: IВ – 12, II – 6, IIIА – 20, IIIВ – 3, IV – 3 пациента. Гистологические формы: липосаркома – 18, недифференцированная саркома – 9, фибросаркома – 8, злокачественная опухоль из оболочек периферических нервов – 3, синовиальная саркома – 3, хондросаркома – 2, лейомиосаркома – 1. Первичные новообразования выявлены у 20 (45 %), рецидивные – у 24 (55 %) больных. По локализации: у 5 (11,3 %) пациентов опухоли выявлены на туловище, у 10 (22,7 %) – в области верхней, у 29 (66 %) – в области нижней конечности.
Пациенты были распределены на три группы:
1-я группа (10 человек): СМТ Т2–3N0M0G1. Первичные новообразования выявлены у 8, рецидивные – у 2 пациентов. Проведено хирургическое лечение с ИФДТ.
2-я группа (17 человек): СМТ T2–3N0M0G2–3. Первичные новообразования выявлены у 6, рецидивные – у 11 пациентов. Проведено хирургическое лечение с ИФДТ.
3-я группа (17 человек): СМТ T2–3N0M0–1G2–3. Первичные новообразования выявлены у 5, рецидивные – у 12 пациентов. Проведено комбинированное лечение: предоперационная лучевая терапия, хирургическое лечение, ИФДТ, неоадъювантная и адъювантная химиотерапия по схеме HD-AI или MAID.
Методика лечения. За 2,5–3 часа до операции внутривенно капельно вводили фотосенсибилизатор хлорин Е6 (Фотолон РУП «Белмедпрепараты», Фоторан ООО Компания «Деко») в дозе 0,8–1,7 мг/кг в 100–250 мл физиологического раствора (с целью профилактики аллергических реакций перед введением фотосенсибилизатора внутримышечно вводили 1 мл 2 %-ного раствора хлоропирамина).
С целью определения степени накопления ФС в опухолевой ткани проводилась флюоресцентная спектрометрия с помощью оптоволоконного спектроанализатора «Леса-6» (Россия) с гелий-неоновым диагностическим лазером «ЛГН 633–25» («БИОСПЕК», Россия). Затем выполняли широкое удаление опухоли мягких тканей с резекцией прилежащих мышц и здоровых мягких тканей, или расширенное удаление опухоли мягких тканей с реконструктивно-пластическим компонентом в зависимости от распространенности процесса (рис. 1).
Затем проводили лазерное облучение ложа опухоли. Применяли аппарат «Латус» (ООО «Аткус» совместно с ЗАО «Полупроводниковые приборы», Россия) и световод с микролинзой (ООО «Полироник», Россия). Мощность излучения – 1,5–2,5 Вт, плотность мощности – 0,08–0,28 Вт/см 2, световая доза – 80 Дж/см 2 при первичных новообразованиях, 100 Дж/см 2 – при рецидивных. Количество и диаметр полей облучения формировали в зависимости от площади операционного поля, с перекрытием полей на 30 %. Кожу вокруг операционного поля, здоровые окружающие ткани, крупные сосуды и нервы экранировали стерильными восьмислойными марлевыми салфетками (рис. 2).
Сроки наблюдения пациентов составили от 14 до 44 месяцев.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ степени накопления ФС показал, что средний индекс контрастности опухоль/здоровая ткань составил 2,8, что свидетельствовало о преимущественном накоплении препарата в ткани опухоли (рис. 3).
Реакций на введение ФС, изменений в ложе опухоли и увеличения сроков заживления раны после ИФДТ не отмечалось. У 20 пациентов наблюдалась незначительная гиперемия и отечность кожи, что купировалось самостоятельно. В указанные сроки наблюдения все пациенты были живы. Локальный рецидив был выявлен у 17 из 44 больных (38,7 %). Всем пациентам с рецидивами провели повторное хирургическое лечение, 2 – с ИФДТ. Анализ рецидивов показал, что в 1-й группе рецидивы были выявлены у 3 пациентов (30 %), во 2-й – у 6 (35,3 %), в 3-й – у 8 пациентов (53,0 %). Из 20 пациентов с первичными новообразованиями диагностированы рецидивы у 6 (30 %). Из 24 пациентов с рецидивами СМТ повторные рецидивы выявлены у 11 (45,8 %). При этом в 20 % случаев выявлены рецидивы непосредственно в зоне лазерного воздействия, в остальных случаях – по периферии послеоперационного рубца – в зонах, не подвергшихся фотодинамическому воздействию, что является важным моментом в оценке эффективности ИФДТ.

Рис. 1. Опухоль в едином блоке с мышцей
Fig. 1. The tumor in a single block with the muscle
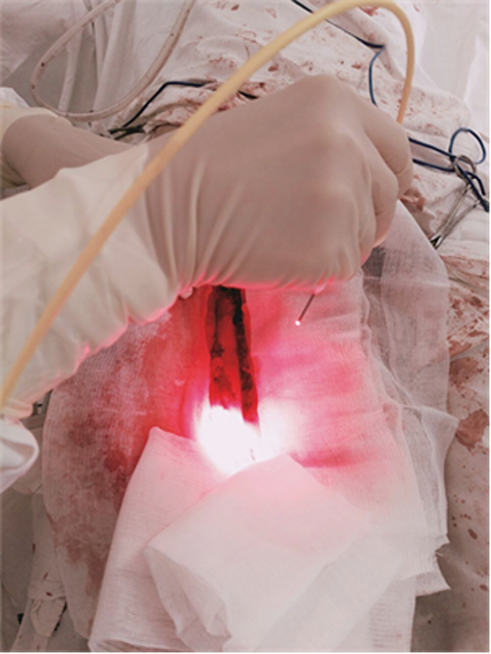
Рис. 2. Сеанс интраоперационной фотодинамической терапии на ложе удаленной липосаркомы
Fig. 2. Intraoperative photodynamic therapy session on the bed of the removed liposarcoma
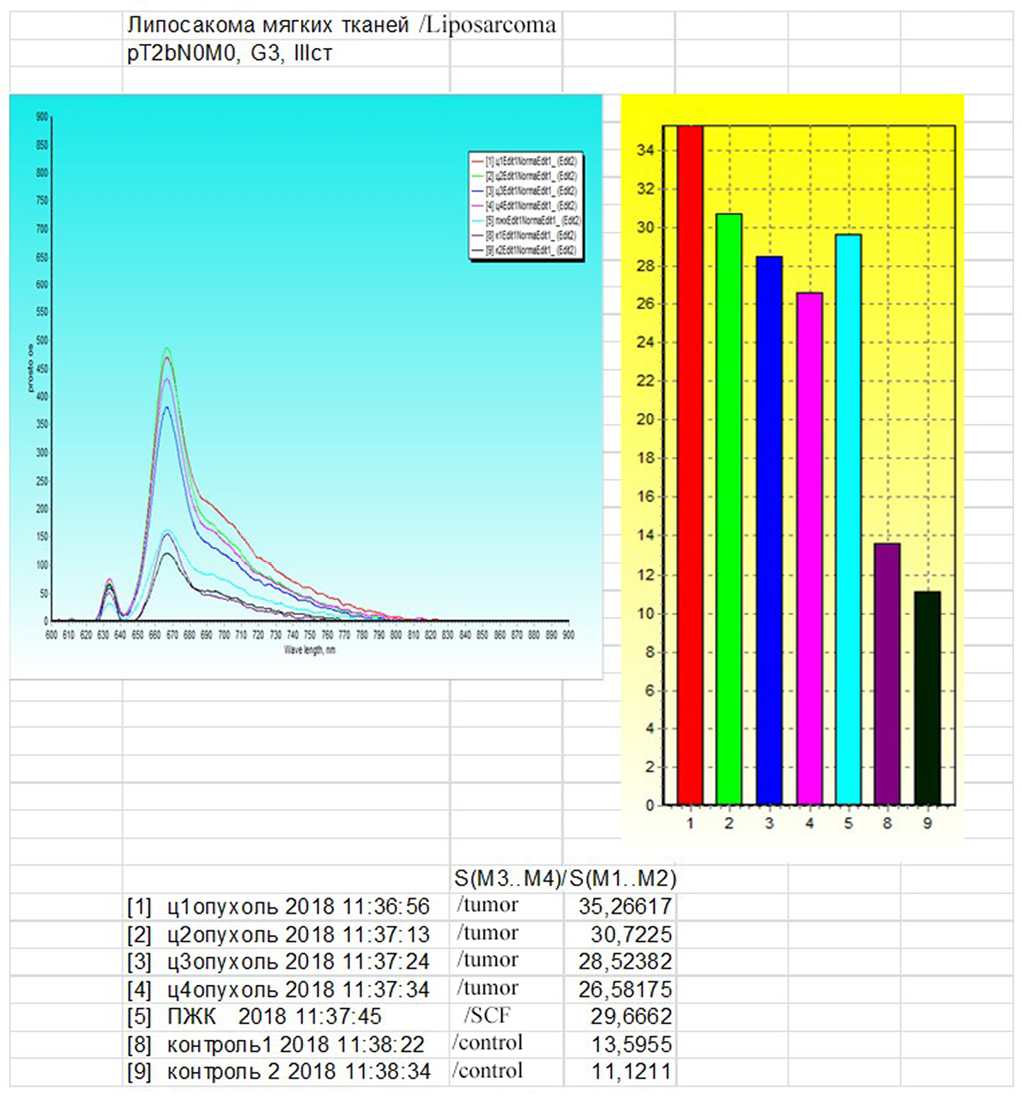
Рис. 3. Спектрометрия липосаркомы через 3 часа после введения фотосенсибилизатора
Fig. 3. Liposarcoma spectrometry 3 hours after photosensitizer administration
КЛИНИЧЕСКИЙ ПРИМЕР
Больной К., 43 года. В 2018 г. установлен диагноз: липосаркома мягких тканей средней трети правой голени Т3N0M0GI, стадия I В. Данных за регионарное и отдаленное метастазирование не получено. По данным спиральной компьютерной томографии в задней группе мышц правой голени имеется образование размерами 10,0 × 9,0 × 14,0 см, негомогенной структуры и плотности, с наличием единичных кальцинатов по периферии. Изменений со стороны большеберцовой и малоберцовой костей в месте прилегания образования нет. Гистологическое исследование: миксоидная липосаркома GI. 21.06.2018 г. внутривенно введен ФС хлорин Е6 в дозе 1,3 мг/кг, через 3 часа после введения проведена флюоресцентная спектрометрия опухоли, средний индекс контрастности опухоль/здоровая ткань – 2,6. Проведено лечение: удаление опухоли мягких тканей правой голени с резекцией задней группы мышц, ИФДТ с ФС хлорин Е6 в дозе 1,3 мг/кг за 3,5 часа до сеанса, доза – 80 Дж/см 2, мощность на выходе – 1,5 Вт, облучение трех полей по 3 и 4 см с перекрытием на 30 %. Сразу после лечения ложе опухоли – без видимых изменений. Гистологическое исследование операционного материала: миксоидная липосаркома GI. Послеоперационный диагноз: липосаркома pT3N0M0GI, стадия I В. Ранних и поздних послеоперационных осложнений не было. Наблюдается без рецидива 3 года.
ЗАКЛЮЧЕНИЕ
Интраоперационная фотодинамическая терапия является безопасным и эффективным методом лечения сарком мягких тканей и перспективным направлением для исследования. Небольшое количество наблюдений, разнообразие гистологических форм и стадий заболевания затрудняет интерпретацию результатов ее эффективности. Это требует дальнейшего изучения интраоперационной фотодинамической терапии.
Список литературы
1. Мацко Д.Е. Современные представления о морфологической классификации сарком мягких тканей и практическое значение. Практическая онкология. 2013; 14 (2): 77–86.
2. Клинические рекомендации по диагностике и лечению больных саркомой мягких тканей. Клинические рекомендации общероссийского союза общественных объединений ассоциации онкологов России. М.; 2018.
3. NCCN Soft Tissue Sarcoma. Version 3/2021. January, 26, 2022.
4. Зубарев А.Л., Курильчик А.А., Курпешев О.К. и др. Локальная гипертермия в комбинированном лечении местнораспространенных сарком мягких тканей. Сибирский онкологический журнал. 2015; 1 (3): 55–60.
5. Хазов А.В. Хирургическое лечение сарком мягких тканей конечностей с применением эндоваскулярных вмешательств и криовоздействия: автореф. дисс. … канд. мед. наук. СПб., 2017.
6. Зубарев А.Л., Игольников И.Б., Кучеров В.В. и др. Интервенционная радиология в лечении сарком мягких тканей. Саркомы костей, мягких тканей и опухоли кожи. 2020; 12 (1): 24–29.
7. Странадко Е.Ф. Основные этапы развития и современное состояние фотодинамической терапии в России. Лазерная медицина. 2012; 16 (2): 4–14.
8. Гельфонд М.Л., Рогачев М.В. Фотодинамическая терапия. Фундаментальные и практические аспекты: учебное пособие. СПб.: НМИЦ онкологии им. Н.Н. Петрова; 2018.
9. Красновский А.А. Фотодинамическая регуляция биологический процессов: первичные механизмы. В кн.: Проблемы регуляции в биологических системах. Под ред. А.Б. Рубина. М. – Ижевск: НИЦ «Регулярная и хаотичная динамика»; 2006: 223–254.
10. Странадко Е.Ф. Механизмы действия фотодинамической терапии. Российский онкологический журнал. 2000; (4): 52–56.
11. Gollnick S.O., Liu X., Owczarczak B., et al. Altered expression of interleukin 6 and interleukin 10 as a result of the photodynamic therapy in vivo. Cancer Res. 1997; 57 (18): 3904–3909.
12. Gollnick S.O., Owczarczak B., Maier P. Photodynamic therapy and anti-tumor immunity. Lasers Surg Med. 2006; 38 (5): 509–515. DOI: 10.1002/lsm.20362
13. Korbelik M., Stott B., Sun J. Photodynamic therapy-generated vaccines: Relevance of tumor cell death expression. Br J Cancer. 2007; 97 (10): 1381–1387. DOI: 10.1038/sj.bjc.6604059
14. Korbelik M., Naraparaju V.R., Yamamoto N. Macrophages-directed immunotherapy as adjuvant to photodynamic therapy of cancer. Br J Cancer. 1997; 75 (2): 202–207. DOI: 10.1038/ bjc.1997.34
15. Васильев Н.Е., Сысоева Г.М., Даниленко Е.Д. Иммунологические аспекты фотодинамической терапии. Медицинская иммунология. 2003; 5 (5-6): 507–518.
16. Каплан М.А., Малыгина А.И., Пономарев Г.В. и др. Фотодинамическая терапия саркомы М-1 крыс с использованием фотосенсибилизатора амидаминхлорина. Российский биотерапевтический журнал. 2015; 14 (1): 53–56. DOI: 10.17650/1726-9784-2015-14-1-53-56
17. Бурмистрова Н.В., Каплан М.А., Михайловская А.А. и др. Фотодинамическая терапия саркомы М-1 с фотосенсибилизаторами «Фотогем», «Фотосенс», «Фотодитазин». В кн.: Экспериментальные аспекты фотодинамической терапии. Под ред. А.Ф. Цыба, М.А. Каплана. Калуга; 2010: 9–33.
18. Малыгина А.И., Михайловская А.А., Пономарев Г.В. и др. Сравнительный анализ противоопухолевой эффективности фотодинамической терапии с фотосенсибилизаторами амидоаминхлорин и липосомальный амидоаминхлорин на экспериментальной модели опухоли (саркома М-1) крыс. Радиация и риск (Бюллетень Национального радиационно-эпидемиологического регистра). 2015; 24 (1): 85–95.
19. Грин М.А., Пантюшенко И.В., Островерхов П.В. и др. Серосодержащие производные бактериохлорофилла А и наноструктурированные фотосенсибилизаторы на их основе. Российский биотерапевтический журнал. 2016; 15 (1): 27.
20. Ярославцева-Исаева Е.В., Каплан М.А. Фотодинамическая терапия ангиосаркомы волосистой части головы как альтернатива хирургическому лечению у больного с тяжелой сопутствующей терапией. Фотодинамическая терапия и фотодиагностика. 2014; 3 (3): 31–33.
21. Namdisan R.N., Karakousis C.P., Holyoke E.D., Dougherty T.J. Intraoperative photodynamic therapy for retroperitoneal sarcomas. Cancer. 1988; 61 (6): 1248–1252. DOI: 10.1002/1097-0142(19880315)61:6<1248::aidcncr2820610632>3.0.co;2-5
22. Филоненко Е.В., Вашакмадзе Л.А., Черемисов В.В., Теплов А.А., Алексеев Б.Я., Смирнова С.В., Хомяков В.М. Способ профилактики рецидивов при хирургическом лечении злокачественных опухолей органов малого таза или неорганных опухолей забрюшинного пространства: Патент № 2486933 Рос. Федерация; МПК A61N 5/067 (2006.01); заявитель и патентообладатель ФГБУ «МНИОИ им. П.А. Герцена Минздравсоцразвития России». № 2011146080/14; заявл. 14.11.2011; опубл. 10.07.2013. 2013; (19).
23. Филоненко Е.В., Сарибекян Э.К., Иванова-Радкевич В.И. Возможности интраоперационной фотодинамической терапии в лечении местно-распространенного рака молочной железы. Biomedical Photonics. 2016; 5 (1): 9–14. DOI: 10.24931/2413-9432-2016-5-1-9-14
24. Гришин Н.А., Сулейманов Э.А., Ложкин М.Н. и др. Циторедуктивное хирургическое лечение с интраоперационной фотодинамической терапией больной с муцинозным канцероматозом брюшины. Biomedical Photonics. 2017; 6 (3): 49–52. DOI: 10.24931/2413-9432-2017-6-3-49-52
25. Каприн А.Д., Сулейманов Э.А., Филоненко Е.В. и др. Интраоперационная фотодинамическая терапия при мезотелиоме брюшины. Biomedical Photonics. 2017; 6 (3): 4–10. DOI: 10.24931/2413-9432-2017-6-3-4-10
Об авторах
Е. В. Ярославцева-ИсаеваРоссия
Ярославцева-Исаева Елена Викторовна – кандидат медицинских наук, ведущий научный сотрудник отделения фотодинамической диагностики и терапии
Обнинск
А. Л. Зубарев
Россия
Зубарев Алексей Леонидович – кандидат медицинских наук, врач отделения комбинированного лечения опухолей костей, мягких тканей и кожи
Обнинск
В. Н. Капинус
Россия
Капинус Виктория Николаевна – кандидат медицинских наук, старший научный сотрудник отделения фотодинамической диагностики и терапии
Обнинск
А. А. Курильчик
Россия
Курильчик Александр Александрович – кандидат медицинских наук, зав. отделением комбинированного лечения опухолей костей, мягких тканей и кожи
Обнинск
В. Е. Иванов
Россия
Иванов Вячеслав Евгеньевич – научный сотрудник отделения комбинированного лечения опухолей костей, мягких тканей и кожи
Обнинск
А. Л. Стародубцев
Россия
Стародубцев Алексей Леонидович – врач отделения комбинированного лечения опухолей костей, мягких тканей и кожи
Обнинск
Рецензия
Для цитирования:
Ярославцева-Исаева Е.В., Зубарев А.Л., Капинус В.Н., Курильчик А.А., Иванов В.Е., Стародубцев А.Л. Интраоперационная фотодинамическая терапия в комбинированном лечении саркомы мягких тканей. Лазерная медицина. 2022;26(3-4):9-15. https://doi.org/10.37895/2071-8004-2022-26-3-4-9-15
For citation:
Yaroslavtseva-Isaeva E.V., Zubarev A.L., Kapinus V.N., Kurilchik A.A., Ivanov V.E., Starodubtsev A.L. Intraoperative photodynamic therapy in the combined treatment of soft tissue sarcoma. Laser Medicine. 2022;26(3-4):9-15. (In Russ.) https://doi.org/10.37895/2071-8004-2022-26-3-4-9-15
JATS XML


























