Перейти к:
Фотодинамическая активность водной дисперсии наночастиц золота при лечении экспериментальных гнойных ран
https://doi.org/10.37895/2071-8004-2021-25-4-35-41
Аннотация
Цель исследования. Антимикробная фотодинамическая терапия является одним из высокоэффективных методов лечения инфекционных поражений кожи и мягких тканей, однако поиск идеальных фотосенсибилизаторов сохраняет свою актуальность. Данная работа посвящена изучению возможности использования водной дисперсии наночастиц золота в качестве потенциального фотосенсибилизатора для антимикробной фотодинамической терапии экспериментальных гнойных ран.
Материалы и методы. На модели экспериментальных полнослойных гнойных ран, сформированных у крыс, была изучена фотосенсибилизирующая способность водной дисперсии наночастиц золота, стабилизированных поливиниловым спиртом, при облучении светом полупроводникового лазера с длиной волны 405 нм («Алком Медика», Санкт-Петербург).
Результаты. У животных экспериментальных групп наблюдалось эффективное, быстрое очищение ран от гнойно-некротического содержимого. Было установлено, что предварительная обработка ран наноструктурами с последующим световым воздействием приводило к сокращению сроков заживления раневых дефектов у лабораторных животных в 1,6 раза по сравнению с контрольной группой.
Заключение. Водная дисперсия наночастиц золота, стабилизированных поливиниловым спиртом, может рассматриваться в качестве эффективного фотосенсибилизатора при проведении антимикробной фотодинамической терапии.
Ключевые слова
Для цитирования:
Шульгина Т.А., Странадко Е.Ф., Нечаева О.В., Глинская Е.В., Зубова К.В., Шнайдер Д.А., Беспалова Н.В. Фотодинамическая активность водной дисперсии наночастиц золота при лечении экспериментальных гнойных ран. Лазерная медицина. 2021;25(4):35-44. https://doi.org/10.37895/2071-8004-2021-25-4-35-41
For citation:
Shulgina T.A., Stranadko E.F., Nechaeva O.V., Glinskaya E.V., Zubova K.V., Schnaider D.A., Bespalova N.V. Photodynamic activity of water dispersion of gold nanoparticles for treating experimental purulent wounds. Laser Medicine. 2021;25(4):35-44. (In Russ.) https://doi.org/10.37895/2071-8004-2021-25-4-35-41
ВВЕДЕНИЕ
Повышение эффективности терапии инфекционных поражений кожи и мягких тканей сохраняет свою актуальность. Это связано с нарастанием частоты встречаемости и распространением антибиотико-резистентных штаммов микроорганизмов, вызывающих гнойно-воспалительные процессы, что приводит к снижению эффективности традиционных методов терапии [1–3]. Еще одним из негативных последствий, связанных с использованием антимикробных препаратов, является развитие побочных реакций: их органотропное действие, возникновение аллергических реакций, дисбиоза и др. Согласно данным, представленным в ряде публикаций, в настоящее время перспективным направлением в лечении данной патологии является антимикробная фотодинамическая терапия (АФДТ) [4–6]. В ее основе лежит местное применение в очаге поражения фотосенсибилизатора (ФС), его селективное накопление в микробных клетках с последующей активацией светом с длиной волны, соответствующей пику поглощения фотосенсибилизатора. В процессе фотодинамической реакции образуется высокоактивный окислитель – синглетный кислород и другие активные формы кислорода (АФК), которые оказывают цитотоксическое действие. Его реализация связана с запуском каскада реакций перекисного окисления липидов и возникновения окислительного стресса, в результате чего происходит повреждение наружной цитоплазматической мембраны клеток и внутриклеточных органоидов, что ведет к гибели и фагоцитозу микробной клетки. В работе Е.В. Логуновой и А.Н. Наседкина [7] показано, что преимуществом АФДТ является локальное воздействие на патогенные микроорганизмы в ране и отсутствие системного воздействия на сапрофитную флору, высокая чувствительность микроорганизмов к действию АФДТ и отсутствие у них механизмов устойчивости, что позволяет применять данный метод для лечения заболеваний, вызванных полирезистентными штаммами микроорганизмов. Эффективность антимикробного фотодинамического воздействия зависит от особенностей строения клеточной стенки бактерий. Так, в обзоре [8] представлен анализ отечественной и зарубежной литературы, который позволяет судить о большей чувствительности грамположительных бактерий по сравнению с грамотрицательными, обладающими более сложной, многослойной наружной капсулой. В настоящее время имеется большое количество экспериментальных работ, посвященных антимикробной фотодинамической терапии гнойных и ожоговых ран, трофических язв сосудистой этиологии, пролежней и пр. [9–11]. Однако повышение эффективности АФДТ связано с поиском новых ФС, одновременно обладающих высокой фототоксичностью и низкой темновой токсичностью, при действии которых образуется достаточное количество АФК, способных преимущественно связываться с клетками микроорганизмов [12]. В клинической практике в качестве перспективных потенциальных ФС могут рассматриваться металлические наноструктуры, в частности наночастицы золота, которые применяются в терапии онкологических заболеваний [13–15].
Цель работы: изучение возможности использования водной дисперсии наночастиц золота в качестве фотосенсибилизатора для антимикробной фотодинамической терапии экспериментальных гнойных ран.
МАТЕРИАЛЫ И МЕТОДЫ
В исследованиях использовали водную дисперсию наночастиц золота, стабилизированных поливиниловым спиртом (AuPVA), предоставленную ООО «М9» (Тольятти) (рис. 1). Проведенные ранее исследования показали, что AuPVA характеризуется широким спектром антимикробной активности в отношении стандартных штаммов и клинических изолятов грамположительных и грамотрицательных бактерий, дрожжевых грибов, а ее рабочие концентрации не оказывают токсического воздействия в отношении биотест-объектов и культуры клеток дермальных фибробластов [16–18].

Рис. 1. Сканирующая электронная микроскопия наночастиц золота, стабилизированных поливиниловым спиртом, в составе водной дисперсии (×2000)
Fig. 1. Scanning electron microscopy of gold nanoparticles stabilized with polyvinyl alcohol in aqueous dispersion (×2000)
В исследованиях использовали белых беспородных крыс (самок), массой 200 ± 20 г, которые содержались на стандартном рационе вивария. Экспериментальные гнойные раны животным моделировали по методике [19]. Для этого на выбритом от шерсти участке межлопаточной области вырезали кожный лоскут с подкожной клетчаткой по контуру, предварительно нанесенному с помощью трафарета. В полученную рану диаметром 15 мм вводили марлевый тампон, содержащий взвесь суточной культуры S. aureus 209 Р в концентрации 109 м.к./мл, после чего рану ушивали. Через 48 часов после операции края раны разводили, тампон удаляли, а рану обрабатывали 3%-ным раствором перекиси водорода для удаления гнойного содержимого. Все эксперименты были выполнены в соответствии с требованиями Федерального закона от 01.01.1997 «О защите животных от жестокого обращения» и предписаниями Женевской конвенции «International Guiding Principles for Biomedical Research Involving Animals» (Geneva, 1990).
Все животные были разделены на 6 групп по 6 животных в каждой:
- группа 1 – контроль, раны без обработки;
- группа 2 – обработка раны гелем «Фотодитагель» («Вета-Гранд», Россия) с экспозицией 30 минут и последующим облучением лазером с длиной волны 670 нм;
- группа 3 – обработка раны водной дисперсией AuPVA;
- группа 4 – обработка раны водной дисперсией AuPVA с экспозицией 10 минут и последующим облучением лазером с длиной волны 405 нм;
- группа 5 – обработка раны водной дисперсией AuPVA с экспозицией 20 минут и последующим облучением лазером с длиной волны 405 нм;
- группа 6 – обработка раны водной дисперсией AuPVA с экспозицией 30 минут и последующим облучением лазером с длиной волны 405 нм.
Опытным группам животных препараты наносили на поверхность раны каждые двое суток. Группам животных 2 и 4, 5 и 6 после нанесения препаратов проводили сеансы АФДТ ран. В группе 2 в качестве источника излучения использовали полупроводниковый лазер с длиной волны излучения 670 нм («Геософт», Москва), в группах 4, 5 и 6 – полупроводниковый лазер с длиной волны 405 нм («Алком Медика», Санкт-Петербург). Дно раны облучали расфокусированным лучом (диаметр пятна облучения ≈ 10 мм, плотность мощности в группе 2 составила 1 Вт/см2, в группах 4, 5 и 6 – 0,2 Вт/см2) сканирующими круговыми перемещениями световода в течение 1 мин.
Течение раневого процесса у экспериментальных животных оценивали по внешнему состоянию раны, а также по изменению площади ее поверхности. Для оценки эффективности санации рассчитывали ежесуточное уменьшение площади ран в % [20]:
 ,
,
где S – ежесуточное уменьшение площади ран, %/сут.; Sp – величина площади раны при предшествующем измерении; Sn – величина площади раны в настоящий момент; t – число дней между первым и последним измерением.
Статистическая обработка результатов проводилась с помощью программного обеспечения Statistica 10.0 for Windows (StatSoft Inc., США), Microsoft Еxcel 2007 for Windows 7 (Microsoft Corp., США). Результаты считались статистически значимыми при p ≤ 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Все животные, участвующие в эксперименте, были живы. На 3-и сутки от начала эксперимента значительных изменений в морфологии раневых дефектов не наблюдалось (рис. 2). Во всех группах животных в ранах наблюдалось присутствие фибринозно-геморрагического экссудата, дно покрыто фибрином, по краям выраженный отек. Статистически незначимое сокращение площади ран происходило в группах 4, 5 и 6.
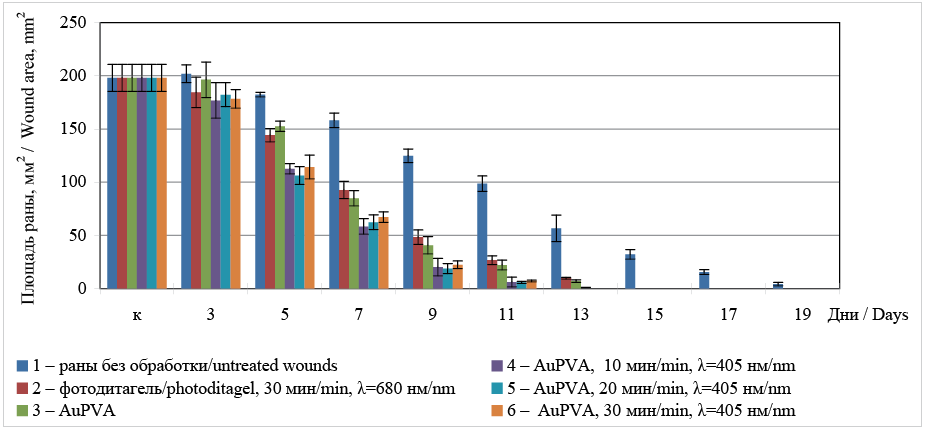
Рис. 2. Динамика изменения площади экспериментальных полнослойных гнойных ран
Fig. 2. Dynamics of changes in the area of experimental full-thickness purulent wounds
К 5-м суткам в экспериментальных группах животных наблюдалось исчезновение перифокального отека, уменьшение количества экссудата и появление краевой эпителизации, что способствовало сокращению площади раневых дефектов, наиболее выраженному в группах 4, 5 и 6. В группе 1 у животных сохранялась отечность ран, в них присутствовал гнойный экссудат, а по краям отмечались некротические участки.
На 7-е сутки от начала эксперимента во всех группах животных происходило достоверное сокращение площади ран, а у животных, раны которых обрабатывали водной дисперсией AuPVA, раневые дефекты очищались от гнойного содержимого. Незначительное количество гнойного экссудата сохранялось в группе 2. Раны контрольной группы сохраняли гиперемию и отечность.
На 9-е сутки площади ран продолжали сокращаться во всех группах животных. Наиболее выраженно этот процесс наблюдался в группах 4, 5 и 6, причем статистически значимых отличий площади ран животных в этих группах установлено не было. Однако в группах сравнения 1, 2 и 3 заживление раневых дефектов протекало медленнее, и их площади составляли 124,8 ± 6,4, 48,4 ± 6,8 и 40,8 ± 8,2 мм2 соответственно. Значительно изменилась морфология ран: во всех экспериментальных группах они полностью очистились от гнойного содержимого, происходила их активная эпителизация.
На 11-е сутки эксперимента наблюдалась сходная динамика сокращения площади раневых дефектов. Полное заживление ран в экспериментальных группах животных 4, 5 и 6 происходило на 13-е сутки, в группах 2 и 3 – на 15-е сутки, а в контрольной группе – на 21-е сутки.
Было установлено, что при проведении АФДТ с использованием в качестве ФС AuPVA скорость очищения экспериментальных ран от гнойного содержимого и их заживление не зависело от продолжительности предварительной экспозиции, что позволяет сократить время воздействия ФС на раневые дефекты до 10 минут.
Наличие поверхностно-активного вещества – поливинилового спирта в составе водной дисперсии AuPVA, с одной стороны, обеспечивает стабилизацию наноструктур, а с другой стороны, вероятно, приводит к повышению проницаемости клеточной стенки микроорганизмов и облегчает проникновение наночастиц [21–23]. Вероятно, очищение и последующее заживление экспериментальных гнойных ран при действии водной дисперсии AuPVA происходило благодаря ее выраженной антимикробной активности, в то время как использование фотодитагеля и облучения стимулировало механизмы неспецифической защиты организма животных, в частности, процессы фагоцитоза, а также активацию Т-клеточного звена [24][25].
ЗАКЛЮЧЕНИЕ
Водная дисперсия AuPVA может рассматриваться в качестве перспективного фотосенсибилизатора для проведения антимикробной фотодинамической терапии гнойных поражений кожи и мягких тканей, поскольку обработка экспериментальных гнойных ран приводила к достоверному уменьшению сроков их заживления в 1,6 раза по сравнению с контролем. Показана большая эффективность применения водной дисперсии AuPVA в сочетании с полупроводниковым лазером с длиной волны 405 нм по сравнению с ее самостоятельным использованием в качестве антисептического средства. Сходные результаты динамики раневого процесса были получены при использовании водной дисперсии AuPVA и Фотодитагеля в комплексе с облучением. Значительным преимуществом применения водной дисперсии AuPVA по сравнению со стандартным фотосенсибилизатором – Фотодитазином, входящим в состав Фотодитагеля, является уменьшение экспозиции воздействия на раневой дефект с 30 до 10 минут, что способствует оптимизации скорости и повышению эффективности антимикробной фотодинамической терапии.
Список литературы
1. Давидович Н.В., Кукалевская К.К., Башилова Е.Н. и др. Основные принципы эволюции антибиотикорезистентности у бактерий (обзор литературы). Клиническая лабораторная диагностика. 2020; 65 (6): 387–393. DOI: 10.18821/0869-2084-2020-65-6-387-393
2. Кузьмин В.Н. Антибиотикорезистентность как эпидемиологическая проблема инфекционно-воспалительных заболеваний в современных условиях. Медицинский оппонент. 2020; 3 (11): 20–26.
3. Hernando-Amado S., Sanz-García F., Martínez J.L. Antibiotic resistance evolution is contingent on the quorumsensing response in Pseudomonas aeruginosa. Mol Biol Evol. 2019; 36 (10): 2238–2251. DOI: 10.1093/molbev/msz144
4. Семенов Д.Ю., Васильев Ю.Л., Дыдыкин С.С. и др. Антимикробная и антимикотическая фотодинамическая терапия (обзор литературы). Biomedical Photonics. 2021; 10 (1): 25–31. DOI: 10.24931/2413-9432-2021-10-1-25-31
5. Wainwright M., Maisch T., Nonell S., et al. Photoantimicrobials – are we afraid of the light? Lancet Infect Dis. 2017; 17 (2): e149–e155. DOI: 10.1016/S1473-3099(16)30268-7
6. Ghorbani J., Rahban D., Aghamiri S., et al. Photosensitizers in antibacterial photodynamic therapy: An overview. Laser Ther. 2018; 27 (4): 293–302. DOI: 10.5978/islsm.27_18RA-01
7. Логунова Е.В., Наседкин А.Н. Современный взгляд на антимикробную фотодинамическую терапию (обзор литературы). Лазерная медицина. 2015; 19 (2): 44–52.
8. Странадко Е.Ф., Кулешов И.Ю., Караханов Г.И. Фотодинамическое воздействие на патогенные микроорганизмы (Современное состояние проблемы антимикробной фотодинамической терапии). Лазерная медицина. 2010; 14 (2): 52–56.
9. Шин Ф.Е., Толстых П.И., Странадко Е.Ф. и др. Фотодинамическая терапия экспериментальных ожоговых ран. Лазерная медицина. 2009; 13 (3): 55–60.
10. Странадко Е.Ф., Корабоев У.М., Толстых М.П. Фотодинамическая терапия при гнойных заболеваниях мягких тканей. Хирургия. 2000; (9): 67–70.
11. Странадко Е.Ф., Толстых П.И., Уринов А.Я. и др. Фотодинамическая терапия гнойно-воспалительных заболеваний мягких тканей у больных пожилого и старческого возраста. Клиническая геронтология. 2000; 6 (5-6): 43–45.
12. Лукьянец Е.А. Поиск новых сенсибилизаторов для фотодинамической терапии. Фотодинамическая терапия и фотодиагностика. 2013; 2 (3): 3–16.
13. Дунаевская В.В., Церковский Д.А., Татарчук Т.Ф., Гончарук И.В. Фотодинамическая терапия в клинической онкологии (аналитический обзор и собственный опыт). Клінічна онкологія. 2020; 10 (3-4): 120–127. DOI: 10.32471/clinicaloncology.2663-466X.39-3.27393
14. Кузнецов В.В. Использование фотодинамической терапии в отечественной онкологии. Research’n Practical Medicine Journal. 2015; 2 (4): 98–105. DOI: 10.17709/2409-2231-2015-2-4-98-105
15. Huang X., Jain P.K., El-Sayed I.H., et al. Plasmonic photothermal therapy (PPTT) using gold nanoparticles. Lasers Med Sci. 2008; 23: 217–228. DOI: 10.1007/s10103-0070470-x
16. Нечаева О.В., Глинская Е.В., Шульгина Т.А. и др. Антимикробная активность водных дисперсий наночастиц золота в отношении возбудителей гнойно-воспалительных заболеваний. Проблемы медицинской микологии. 2021; 23 (2): 117.
17. Шульгина Т.А., Верховский Р.А., Нечаева О.В., Мыльников А.М.. Оценка цитотоксического действия наночастиц золота, стабилизированных полимерными соединениями, на культуру клеток фибробластов мыши L929. Проблемы медицинской микологии. 2020; 22 (3): 151.
18. Shulgina T., Nechaeva О., Torgashova А., Darin N. Using the method of biotesting to assess the toxicity of waste medical and biological practices containing nanomaterials. IOP Conference Series: Earth and Environmental Science. 2019; 337: 012012. DOI: 10.1088/1755-1315/337/1/012012
19. Григорьян А.Ю., Бежин А.И., Панкрушева Т.А. и др. Иммобилизованные формы антисептиков для лечения гнойных ран в эксперименте. Человек и его здоровье. 2011; (4): 25–34.
20. Кузин М.И., Костюченок Б.М. Раны и раневая инфекция: Руководство для врачей. М.: Медицина; 1990.
21. Krutyakov E.A., Kudrinsky A.A., Zherebin P.M., et al. Tallow amphopolycarboxyglycinate-stabilized silver nanoparticles: New frontiers in development of plant protection products with a broad spectrum of action against phytopathogens. Materials Research Express. 2016; 3 (7): 075403. DOI: 10.1088/2053-1591/3/7/075403
22. Jin N., Zhang Q., Yang M., et al. Detoxifi cation and functionalization of gold nanorods with organic polymers and their applications in cancer photothermal therapy. Microsc Res Tech. 2019; 82 (6): 670–679. DOI: 10.1002/jemt.23213
23. Wu J.J., Lee G.J., Chen Y.S., Hu T.L. The synthesis of nanosilver/polypropylene plastics for antibacterial application. Curr Appl Phys. 2012; 12 (Suppl 2): 89–95. DOI: 10.1016/j.cap.2012.02.026
24. Абакушина Е.В., Романко Ю.С., Каплан М.А., Каприн А.Д. Противоопухолевый иммунный ответ и фотодинамическая терапия. Радиация и риск (Бюллетень Национального радиационно-эпидемиологического регистра). 2014; 23 (4): 92–98.
25. Анохин Ю.Н., Абакушина Е.В. Опухолеспецифический иммунный ответ после фотодинамической терапии. Медицинская иммунология. 2016; 18 (5): 405–416. DOI: 10.15789/1563-0625-2016-5-405-416
Об авторах
Т. А. ШульгинаРоссия
Шульгина Татьяна Андреевна – биолог бактериологической лаборатории, Научно-исследовательский институт травматологии, ортопедии и нейрохирургии
Саратов
Е. Ф. Странадко
Россия
Странадко Евгений Филиппович – доктор медицинских наук, профессор, руководитель отделения лазерной онкологии и фотодинамической терапии
Москва
О. В. Нечаева
Россия
Нечаева Ольга Викторовна – доктор биологических наук, профессор кафедры «Экология и техносферная безопасность»; биолог бактериологической лаборатории
Саратов
Е. В. Глинская
Россия
Глинская Елена Владимировна – кандидат биологических наук, доцент кафедры микробиологии и физиологии растений
Саратов
К. В. Зубова
Россия
Зубова Ксения Валерьевна – аспирант кафедры микробиологии и физиологии растений
Саратов
Д. А. Шнайдер
Россия
Шнайдер Дмитрий Александрович – главный врач
Саратов
Н. В. Беспалова
Россия
Беспалова Наталья Викторовна – кандидат физико-математических наук, доцент кафедры «Информационная безопасность автоматизированных систем»
Саратов
Рецензия
Для цитирования:
Шульгина Т.А., Странадко Е.Ф., Нечаева О.В., Глинская Е.В., Зубова К.В., Шнайдер Д.А., Беспалова Н.В. Фотодинамическая активность водной дисперсии наночастиц золота при лечении экспериментальных гнойных ран. Лазерная медицина. 2021;25(4):35-44. https://doi.org/10.37895/2071-8004-2021-25-4-35-41
For citation:
Shulgina T.A., Stranadko E.F., Nechaeva O.V., Glinskaya E.V., Zubova K.V., Schnaider D.A., Bespalova N.V. Photodynamic activity of water dispersion of gold nanoparticles for treating experimental purulent wounds. Laser Medicine. 2021;25(4):35-44. (In Russ.) https://doi.org/10.37895/2071-8004-2021-25-4-35-41
JATS XML


























