Перейти к:
2011–2021 – еще 10 лет развития лазерной медицинской техники и технологий
https://doi.org/10.37895/2071-8004-2021-25-2-63-74
Аннотация
В работе представлен обзор лазерных медицинских аппаратов и лазеров для них, а также медицинских технологий на их основе, разработанных за последнее десятилетие.
Для цитирования:
Минаев В.П. 2011–2021 – еще 10 лет развития лазерной медицинской техники и технологий. Лазерная медицина. 2021;25(2):63-74. https://doi.org/10.37895/2071-8004-2021-25-2-63-74
For citation:
Minaev V.P. 2011-2021 – Ten more years of development of laser medical equipment and technologies. Laser Medicine. 2021;25(2):63-74. (In Russ.) https://doi.org/10.37895/2071-8004-2021-25-2-63-74
В этом году исполняется 60 лет со времени первого использования лазерного излучения в медицине. В течение десятилетия, прошедшего с опубликования предыдущего обзора [1], продолжал расширяться арсенал лазерных аппаратов, разрабатывались новые эффективные медицинские технологии. Радует, что в этом процессе значительным оказался вклад российских врачей, физиков и инженеров, чьи результаты во многих случаях идут впереди результатов их зарубежных коллег. Обзору наиболее интересных из них, с точки зрения автора, и посвящена настоящая публикация.
Наибольший прогресс пришелся на долю аппаратов, использующих волоконные лазеры. Это прежде всего относится к устройствам с лазерами на активированном тулием (Tm) волокне с длиной волны излучения вблизи λ = 1,94 мкм, совпадающей с локальным максимумом поглощения в воде. С использованием такого излучения получил развитие разработанный МФЦ «Фотомед» (Челябинск) метод лазерной остеоперфорации [2], первоначально использовавший излучение с длиной волны λ = 0,97 мкм. К ранее разработанным применениям остеоперфорации при лечении остеомиелита и костной травмы добавилось использование ее для лечения дегенеративно-дистрофических заболеваний костей у детей (болезней Легга – Кальве – Пертеса, Келера II и Осгуда – Шлаттера), позволяющее избежать инвалидизации, вернуть пациентов к нормальной жизни. Кроме этого, метод лазерной остеоперфорации оказался эффективным средством при синдроме диабетической стопы.
Это же излучение в сочетании с излучением с длиной волны λ = 1,55 мкм эффективно используется при лечении сосудистых мальформаций. Примером эффективного применения такого сочетания излучений может служить лечение у новорожденной девочки гигантской лимфангиомы, результаты которого представлены на рисунке 1 [3].
В последние годы резко возрос интерес к использованию излучения диапазона длин волн вблизи λ = 1,9 мкм для лечения варикозно расширенных вен методом эндовенозной лазерной коагуляции (ЭВЛК) [4]. Использование такого излучения позволяет снизить уровень мощности излучения без снижения эффективности лечения, уменьшить вероятность появления карбонизации и болевые ощущения у пациентов.
Эффективность лазеров этого диапазона оценили и лор-хирурги [5].
Но наибольший успех тулиевых волоконных лазеров пришелся на долю мощных отечественных аппаратов для урологии – двухволнового аппарата «Уролаз», ориентированного на хирургию мягких тканей [6], аппарата FiberLase U2, предназначенного для литотрипсии – лечения мочекаменной болезни [7], а также аппарата FiberLase U3, сочетающего обе эти возможности. Эти аппараты существенно превосходят предыдущего лидера рынка, аппараты на основе АИГ:Но – Pulse 120H от компании Lumenis (Израиль – США). Сравнить эти аппараты и их характеристики можно по фотографии на рисунке 2 и в таблице 1.
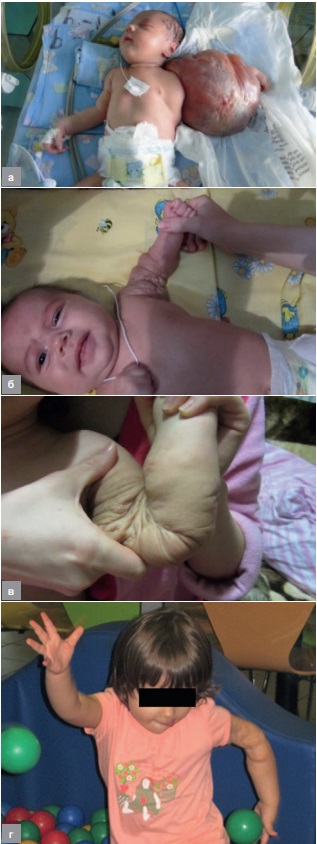
Рис. 1. Лимфангиома на руке и результат ее лечения: а – через 2 дня после рождения, перед операцией; б – через 4 месяца; в, г – через 3 и 4 года после лечения
Fig. 1. Large cystic limphangioma of the left upper extremity and outcome of its treatment: a – two-day old girl, before the surgery; б – 4 months after the surgery; в, г – 3 and 4 years after the treatment

Рис. 2. Лазерные аппараты: а – Уролаз (FiberLase U1), б – Pulse 120H
Fig. 2. Laser devices: а – “Urolas” (“FiberLase U1”), б – “Pulse 120H”
Таблица 1
Лазерные аппараты с длиной волны излучения около λ = 2 мкм
Table 1
Laser devices with radiation wavelength near λ = 2 µm
|
Аппарат Device |
FiberLaseU1 (Уролаз) (Urolas) |
FiberLaseU2 |
FiberLaseU3 |
Pulse 120H |
|
λ, мкм λ, µm |
1,94 ± 1,55 |
1,94 |
2,1 |
|
|
Активная среда Active medium |
Волокна с Tm и Er Fibers with Tm and Er |
Волокно с Tm Fiber with Tm |
АИГ:Но Ho:YAG |
|
|
Средняя мощность, Вт Average power, W |
120 ± 15 |
40 |
60 |
120 |
|
Пиковая мощность, Вт Peak power, W |
120 ± 15 |
400 |
500 |
|
|
Масса, кг Weight, kg |
38 |
245 |
||
|
Габариты, см Sizes, cm |
55 × 46 × 29 |
47 × 116 × 105 |
||
|
Питание Power supply |
220 В, < 10 A 220 V, < 10 A |
220 В, < 5 A 220 V, < 5 A |
220 В, < 10 A 220 V, < 10 A |
220 В, < 46 А 220 V, < 46 A |
|
Производитель Manufacturer |
НТО «ИРЭ-Полюс», Россия STA IRE-Polus, Russia |
Lumenis, Израиль – США Israel – USA |
||
Возможности этих аппаратов и удобство работы с ними по достоинству оценили российские и зарубежные врачи.
Использование излучения λ = 1,94 мкм позволило реализовать при операциях энуклеации доброкачественной гиперплазии предстательной железы и немышечно-инвазивного рака мочевого пузыря режим гидродинамического рассечения мягких тканей, обеспечивающий ряд преимуществ в хирургической урологии.
На рисунке 3 [8] представлена теневая фотография результата введения через волоконный световод в физиологический раствор – среду, обычно используемую при трансуретральных урологических операциях, – мощного (120 Вт) непрерывного излучения с длиной волны λ = 1,94 мкм, которое поглощается в слое около 0,1 мм. Результаты исследований [8, 9] показали, что в этом случае вследствие интенсивного кипения у торца световода (1) образуется парогазовый пузырь (2). Содержимое этого пузыря практически не поглощает излучения, которое проходит до дистального конца пузыря. Образование такого пузыря получило название «эффект Моисея» (Moses effect, отсылка к библейскому сюжету, когда перед Моисеем расступилось море) [10]. При этом на дистальном конце пузыря формируется двухфазная струя, состоящая из нагретой воды и парогазовых микропузырей. Скорость этой струи может достигать величины 3–5 м/с, благодаря чему она может рассекать мягкие ткани.
В результате в среде физиологического раствора возможны три способа воздействия на мягкие биоткани, которые проиллюстрированы на рисунке 4 на примере операции энуклеации доброкачественной гиперплазии мочевого пузыря [9].
- При контактном воздействии между торцом оптического волокна и тканью практически нет жидкости, ее остаток и водная составляющая ткани быстро испаряются, а органическая компонента ткани разогревается до температуры карбонизации. В результате происходит разогрев торца волокна и прилегающей ткани до высокой температуры, о чем свидетельствует яркое свечение места контакта (рис. 4, а). Образующаяся из-за кипения струя существенной роли не играет, и рассечение происходит вследствие совместного воздействия лазерного излучения и разогретого торца волокна, как при контактном воздействии в газовой среде. При этом имеет место заметная карбонизация ткани, а возникающее свечение значительно маскирует процессы, происходящие в месте рассечения.
- Если при воздействии выходной торец световода находится от биоткани на расстоянии, не превышающем длины парогазового пузыря (3, рис. 4, б), воздействие происходит в режиме «эффекта Моисея» в результате непосредственного воздействия на ткань лазерного излучения. Поскольку излучение поглощается в основном водной компонентой биоткани, наблюдается незначительная карбонизация ткани в области разреза в местах с повышенным поглощением в неводных компонентах (например, на сосудах). Значительная часть карбонизированной ткани удаляется излучением в результате повышенного поглощения. При этом яркое свечение в месте воздействия отсутствует, и хирург имеет возможность хорошо различать удаляемую патологическую и подлежащую ткани.
III. В случае когда биоткань не соприкасается с пузырем (рис. 4, в), основным механизмом формирования разреза становится лазер-индуцированное гидродинамическое воздействие двухфазной струи (2). Очевидно, что оно будет наиболее эффективным вблизи дистального конца пузыря, где скорость струи максимальна. В этом случае карбонизация практически не наблюдается, как и в предыдущем случае, отсутствует яркое свечение, и хирург имеет возможность хорошо различать удаляемую патологическую и подлежащую ткани.
Особенно эффективной работа в режиме лазер-индуцированного рассечения оказывается при операциях по удалению неинвазивно-мышечного рака мочевого пузыря единым блоком. На рисунке 5 представлены фотографии [9], полученные в процессе резекции стенки мочевого пузыря с опухолью единым блоком с использованием импульсно-периодического лазерного излучения с длиной волны λ = 1,94 мкм с импульсной мощностью 120 Вт и средней мощностью 10 Вт (1 Дж, 10 Гц) при бесконтактном воздействии с использованием режимов II и III. Благодаря отсутствию яркого свечения, характерного для контактной резекции (режим I), хирург хорошо видит мышечный слой (2, рис. 5), что позволяет деликатно отделить от него опухоль (3, рис. 5) единым блоком и удалить ее целиком. После отделения опухоли на эндоскопическом снимке (рис. 5, в) наблюдается мышечный слой без следов карбонизации и кровотечения.
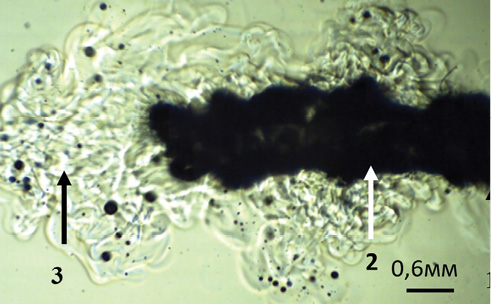
Рис. 3. Теневая картина лазер-индуцированных процессов вблизи выходного торца рабочего волокна через 5 мс после подачи излучения. 1 – торец световода, 2 – парогазовый макропузырь, 3 – двухфазная струя
Fig. 3. Shadow photo of laser-induced processes near the fiber end-face 5 sec after light supply; 1 – fiber end-face, 2 – vapor-gas macrobubble, 3 – two-phase jet
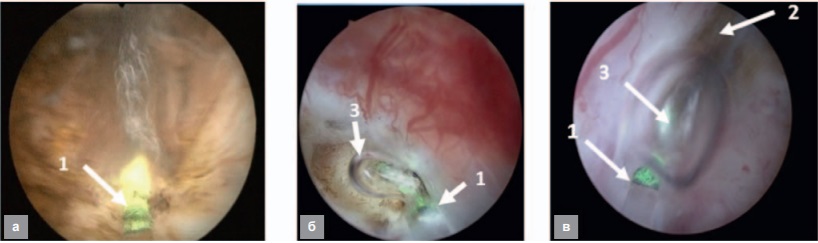
Рис. 4. Варианты лазерного воздействия на мягкие ткани в среде физиологического раствора: а – контактное, б – с «эффектом Моисея», в – в режиме гидродинамического рассечения, 1 – торец световода, 2 – двухфазная струя, 3 – макропузырь
Fig. 4. Variants of laser light impact at soft tissue: a – contact, б – “Moses effect”; в – two-phase jet dissection, 1 – fiber end-face, 2 – two-phase jet, 3 – macrobubble
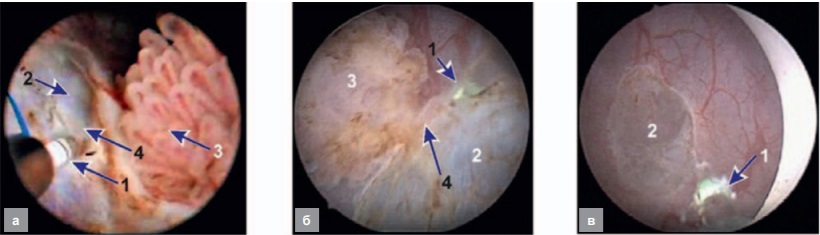
Рис. 5. Лазерная резекция стенки мочевого пузыря с опухолью единым блоком: а, б – процесс резекции, в – мышечный слой на месте удаленной опухоли, 1 – торец световода, 2 – мышечный слой, 3 – опухоль, 4 – место рассечения
Fig. 5. Laser single block dissection of the bladder wall with a tumor: a, б – resection process, в – muscle layer at the site of the removed tumor, 1 – fiber end-face, 2 – muscle layer under the removed tumor, 3 – tumor, 4 – site of resection
Отметим, что, в отличие от вапоризации опухоли, ее удаление в режиме лазер-индуцированного рассечения позволяет уменьшить вероятность образования фрагментов патологической ткани, которые, флотируя в физиологическом растворе, могут попасть на стенку и стать причиной рецидива. Кроме того, в этом случае удается получить хороший материал для гистологических исследований.
Аппараты с излучением 1,94 мкм оказываются более эффективными по сравнению с аппаратами с длиной волны λ = 2,09 мкм и при литотрипсии. Их использование позволяет увеличить скорость литотрипсии, уменьшить миграцию камней из-за ретропульсии в результате возникающих реактивных сил [11].
Дополнительным преимуществом волоконных лазеров по сравнению с лазерами на кристаллах является простота введения рабочего излучения в тонкие рабочие световоды. Это, в свою очередь, позволяет упростить малоинвазивное трансуретральное воздействие на камни в почках с использованием тонких гибких эндоскопов, а также микроперкутанную нефролитотрипсию [12] в случаях, когда большие размеры камня затрудняют осуществление литотрипсии трансуретрально. В последнем случае воздействие осуществляется через прокол с помощью набора «всевидящая игла» (рис. 6, а), включающего тубус диаметром 4,8 F (1,6 мм), через который вводится полужесткая оптика MicroPerc от PolyDiagnost GmbH (Германия) с диаметром 0,9 мм (рис. 6, б), лазерный световод и перфузионная трубка, позволяющая при необходимости осуществлять ирригацию и контрастирование.
На рисунке 7 представлена фотография осуществления А.Г. Мартовым (ГКБ им. Д.Д. Плетнева, Москва) транскутанной литотрипсии в почке. На этом же рисунке показано изображение с монитора эндоскопа. Кроме этого, во время операции осуществлялся еще и рентгеновский контроль.
Использование столь тонкого прокола позволяет уменьшить инвазивность вмешательства, сократить кровопотери при операции и время заживления послеоперационной раны.
Представляется важным, что кроме НТО «ИРЭ-Полюс» разработку аппаратов на основе лазера с Tm-активированном волокном выполнили в Федеральном ядерном центре — ВНИИ технической физики им. Е.И. Забабахина (г. Снежинск). Разработанный там аппарат для хирургии ЛТН-101 (рисунок 8) обеспечивает мощность излучения до 40 Вт на длинах волн λ = 1,91 или 1,94 мкм [13].
Прогресс в технологии полупроводниковых лазеров позволил вывести на рынок аппараты синего (λ = 0,45 мкм) диапазона. Эти аппараты с успехом используются в гинекологии, проктологии, дерматологии и других областях медицины. Лидерами в этой области оказались украинские коллеги из «Фотоники Плюс» (Черкассы), выпускающие с 2013 г. аппарат «Лика-хирург-М» с мощностью излучения до 7 Вт.
Пока в России были доступны только импортные аппараты, но в 2021 г. был зарегистрирован и отечественный аппарат Alta-Soyuz-Blue (НТО «ИРЭ-Полюс»). Этот аппарат выполнен в двухволновом варианте: имеет кроме волоконного вывода излучения с длиной волны λ = 0,45 мкм мощностью до 13 Вт дополнительный волоконный вывод излучения с длиной волны λ = 1,55 мкм с мощностью до 1,5 Вт от волоконного лазера. Фотографии аппаратов «Лика-хирург-М» и Alta-Soyuz-Blue представлены на рисунке 9.

Рис. 6. «Всевидящая игла» в сборе (a) и полужесткая оптическая система MicroPerc от PolyDiagnost GmbH (Германия) (б)
Fig. 6. Assembled “all-seeing needle” (a), semi-rigid optical system “MicroPerc” (“PolyDiagnost GmbH”, Germany) (б)
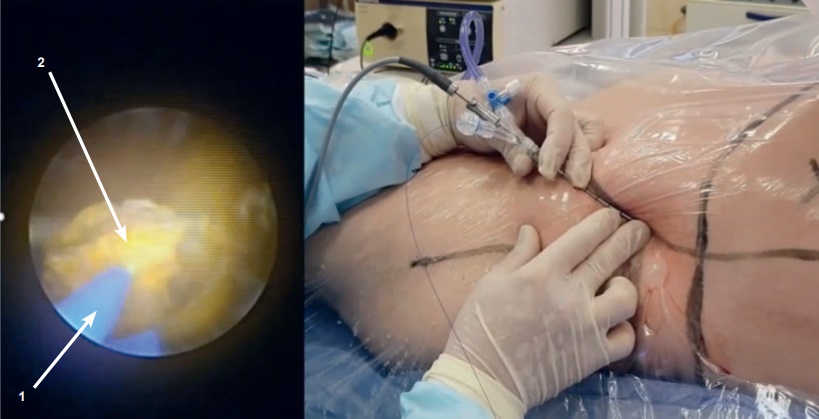
Рис. 7. Лазерная транскутанная литотрипсия камня в почке. Слева — изображение с экрана видеоэндоскопа: 1 – световод, 2 – разрушаемый камень
Fig. 7. Laser transcutaneous lithotripsy in a patient with a kidney stone. Left – photo taken from video endoscope screen: 1 – fiber, 2 – stone

Рис. 8. Лазерный аппарат для хирургии ЛТН-101
Fig. 8. Laser device for surgery ЛТН-101

Рис. 9. Лазерные аппараты для хирургии: а – «Лика-хирург-М» (λ = 0,45 мкм, 7 Вт) от «Фотоники Плюс» (Украина), б – двухволновой Alta-Soyuz-Blue (λ = 0,45 ± 1,55 мкм / 13 ± 1,5 Вт) НТО «ИРЭ-Полюс» (Россия)
Fig. 9. Laser devices for surgery: a – “Lika-chirurg-M” (λ = 0.45 µm, 7 W) manufactured by “Fotonika Plus”, Ukraine; б – two wavelengths “Alta-Soyuz-Blue” (λ = 0.45 ± 1.55 µm / 13 ± 1.5 W) manufactured by STA “IRE-polus”, Russia
Разработки в области волоконных лазеров позволили создать серьезный задел для совершенствования аппаратов для хирургии, работающих еще в двух диапазонах.
Используя удвоение частоты в кристаллах с регулярной доменной структурой, в НТО «ИРЭ-Полюс» разработали линейку надежных и эффективных волоконных лазеров видимого диапазона с длинами волн излучения λ = 0,54; 0,56; 0,59; 0,62 и 0,66 мкм и мощностью 10–20 Вт. Эти лазеры существенно превосходят по эффективности аппараты, выполненные на традиционных твердотельных лазерах [14], используемых в медицинском лазеростроении. В таблице 2 приведены основные характеристики лазеров из этой линейки. Для сравнения в таблице приведены характеристики аппарата QuadroStar PRO 577 от компании AsclepionLT GmbH (Германия).
Даже с учетом того, что в таблице приведены данные ОЕМ-лазеров и коммерческого лазерного аппарата, видно серьезное потенциальное преимущество разработанных волоконных лазеров.
Для многих применений представляет интерес излучение с длиной волны около 3 мкм, наиболее сильно поглощаемое водой. В течение долгого времени для получения излучения этого диапазона использовались только лазеры на кристаллах, активированных эрбием (Er), прежде всего АИГ:Er (λ = 2,94 мкм) и ИСГГ:Er (λ = 2,78 мкм). На основе волоконных лазеров и кристаллов с регулярной доменной структурой в НТО «ИРЭ-Полюс» были разработаны параметрические оптические генераторы (ПОГ), существенно превосходящие выпускаемые аппараты [14]. В таблице 3 приведены для сравнения технические характеристики лазерного аппарата на основе АИГ:Er, выпускаемого Сибирским лазерным центром (Новосибирск), и макета аппарата для хирургии ПОГ, выполненного в корпусе серийного аппарата семейства MedLase.
Таблица 2
Лазерные модули и лазерный аппарат видимого диапазона
Table 2
Laser modules and laser device of the visible spectrum range
|
Обозначение Parameters |
VLM 536-10 |
VLM 561-15 |
VLM 589-15 |
VLM 623-20 |
VLM 660-10 |
QuadroStar PRO 577 |
|
Рмакс, Вт Pmax, W |
10 |
15 |
15 |
20 |
10 |
5 |
|
λ, нм λ, nm |
536 |
562 |
589 |
623 |
660 |
577 |
|
КПД, % Unit efficiency, % |
5 |
6 |
5 |
7 |
5 |
|
|
Питание, В Power, V |
24 |
220 |
||||
|
Охлаждение Cooling |
Воздушное Air |
Воздушное Air |
||||
|
Габариты, см Size, cm |
52,5 × 4,3 × 21,7 + излучатель/handpiece 23,3 × 5 × 4,6 |
42 × 38 × 19 |
||||
|
Масса, кг Weight, kg |
4,5 |
12 |
||||
Таблица 3
Лазерные аппараты диапазона λ ≈ 3 мкм
Table 3
Laser devices of the range λ ≈ 3 µm
|
Параметры Parameters |
«Litetouch» |
Аппарат с ПОГ Experimental device with POG |
|
Длина волны, мкм Wavelength, mkm |
2,94 |
3,05 ± 3,2 |
|
Максимальная выходная мощность, Вт Maximal output power, Wt |
8,4 |
25 |
|
Вес, прибор, кг Weight, kg |
27 |
10 |
|
Габариты, прибор/аппликатор, см Dimensions, device/applicator, cm |
40 × 28 × 75 |
35 × 30 × 45 |
На рисунке 10 представлены фотографии аппарата «Litetouch» от израильской компании «Syneron», опытного образца аппарата с аппликатором, содержащим ПОГ, и второго варианта аппликатора с ПОГ для этого аппарата. Поскольку для диапазона λ = 3 мкм не существует доступных эффективных гибких световодов, в макете ПОГ смонтированы непосредственно в аппликаторах, к которым по световодам подается излучение накачки.
Заметный прогресс за прошедшее десятилетие произошел в области лазеров с длительностью импульсов в фемтосекундном диапазоне. Напомним, что особенностью воздействия на биоткани лазерного излучения фемтосекундной длительности является прежде всего то, что благодаря малому времени действия поглощенная энергия идет на абляцию вещества из области, в которой было поглощено излучение, и тепло не успевает распространиться в прилегающие области. Происходит «холодная» абляция, которую хорошо иллюстрирует [16] рисунок 11, показывающий, что в результате лазерного воздействия на спичечную головку происходит абляция воспламеняющегося состава без его воспламенения.
Еще одной особенностью таких лазеров является то, что при фокусировке в пятно малого диаметра в области фокуса из-за нелинейных процессов наблюдается сильное поглощение излучения, которое при обычных условиях не поглощается.
Эти свойства используются в принципе действия лазерного кератома «ФемтоВизум» (ООО «ОптоСистемы, Троицк, Москва) [17], использующего волоконный фемтосекундный лазер с длиной волны λ = 1,03 мкм. Лазер работает в импульсно-периодическом режиме с длительностью импульсов 200–400 фс, частотой следования 1 МГц и энергией импульса 250–750 нДж. Благодаря острой фокусировке (диаметр фокального пятна менее 2 мкм) излучение, не поглощаясь, проходит через вещество роговицы и поглощается в фокусе с образованием небольшого кавитационного пузыря, разрушающего роговицу. Благодаря этому можно осуществлять тонкие разрезы в роговице (рисунок 12, а), в частности формировать при проведении операции по коррекции зрения ЛАСИК роговичный клапан толщиной менее 90 мкм.
С помощью этой же установки можно обеспечить формирование профиля роговичного трансплантата и посадочного места для него при пересадке трупной роговицы при лечении бельма (рисунок 12, б), что позволяет обеспечить надежную фиксацию трансплантата [18].
Ученые МГУ им. М.В. Ломоносова и Объединенного института высоких температур РАН на основе фемтосекундных лазеров разработали вспомогательные репродуктивные технологии, позволяющие, в частности, решить такую деликатную проблему, как безопасная маркировка яйцеклеток при осуществлении экстракорпорального оплодотворения (ЭКО). В связи с тем, что эта процедура стала весьма популярной в мире, стали происходить случаи, когда были перепутаны хранящиеся яйцеклетки. Речь шла уже о десятках таких случаев. Так, в 2002 г. в результате такого инцидента у белой супружеской пары родилась темнокожая двойня. Разработанная технология [19] позволяет с помощью сфокусированного импульсно-периодического лазерного излучения с длиной волны λ = 514 нм с длительностью импульсов 280 фс, следующих с частотой 2,5 кГц, нанести на оболочку яйцеклетки маркировку. При этом не наносится повреждений эмбриону. На рисунке 13а представлена микрофотография яйцеклетки с нанесенной маркировкой (стрелка). При этом маркировка остается на оболочке после выхода эмбриона, что может быть использовано для документирования. Еще одно применение фемтосекундного излучения – перфорация оболочки яйцеклетки с целью облегчения выхода из нее эмбриона (рис. 13, б).
С точки зрения хирургических применений большой интерес представляет лазерное излучение с длиной волны около 6 мкм, которое ранее было доступно в столь сложных устройствах, как лазеры на свободных электронах [20]. Эти длины волн приходятся на сильные пики поглощения воды и коллагена.
Ученые Томского государственного университета разработали лазер на парах стронция «Кулон-05Sr», обеспечивающий среднюю выходную мощность излучения до 5 Вт на длине волны λ = 6,45 мкм [21]. Длительность импульсов излучения 50 нс при частоте следования 10–20 кГц, потребление – 1,9 кВт, вес – 43 кг, габариты – 35,5 × 18,5 × 126 см. Более того, выходное излучение этого лазера исходно содержит еще излучение с длиной волны около λ = 3 мкм, также сильно поглощаемое биотканями, и небольшую добавку на длине волны λ = 1 мкм. Спектральный состав излучения аппарата «Кулон-05Sr» представлен на рисунке 14 [21].
Этот лазер предполагается зарегистрировать в качестве медицинского аппарата. Недостатком его, как и всех лазеров на парах металлов, является большое (около 0,5 часа) время выхода на режим. Но этот недостаток перекрывается возможностью использовать излучение с уникальными свойствами от доступного аппарата.
За последнее десятилетие в экономически развитых странах наблюдается тенденция роста заболеваний опухолями головного мозга. Не миновала эта тенденция и Россию: у нас ежегодно диагностируется около 10 000 новых случаев. У всех на памяти уход из жизни по этой причине известных соотечественников. Не менее 5 % этих опухолей имеет глубокую локализацию и мультифокальный рост и распространяется в функционально важные зоны мозга [21]. В этих случаях их трудно удалить микрохирургически, без нарушения функциональности мозга. Серьезным потенциалом обладает лазерная интерстициальная термотерапия (интерстициальная лазерная термодеструкция), при которой разрушение опухолей происходит за счет их контролируемого нагрева подводимым по световоду лазерным излучением. Это возможно благодаря более высокой чувствительности злокачественных клеток к нагреву по сравнению со здоровыми.
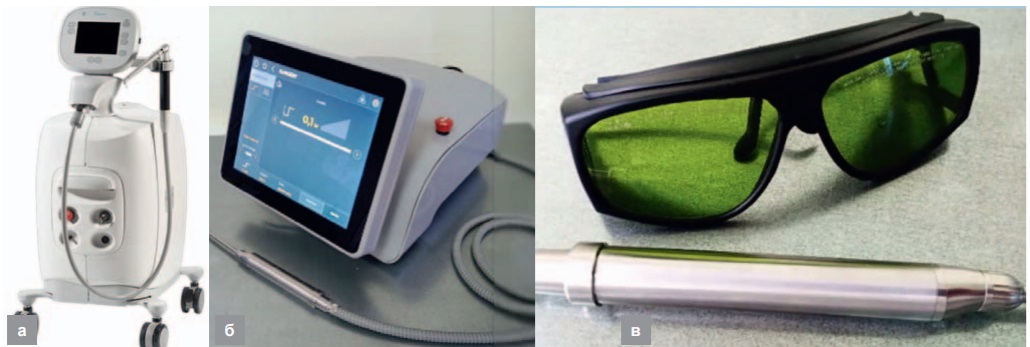
Рис. 10. Аппараты для хирургии диапазона λ = 3 мкм: а – «Litetouch», б – макет аппарата с ПОГ в аппликаторе, в – второй вариант аппликатора с расположенным в нем ПОГ
Fig. 10. Devices for surgery with wavelength near λ = 3 µm: a – “Melas-C”, б – experimental device with POG in the applicator, в – the second variant of applicator with POG

Рис. 11. Результат воздействия импульсов излучения с длительностью ~10 фс
Fig. 11. Results of irradiation with laser pulses, duration ~10 fsec
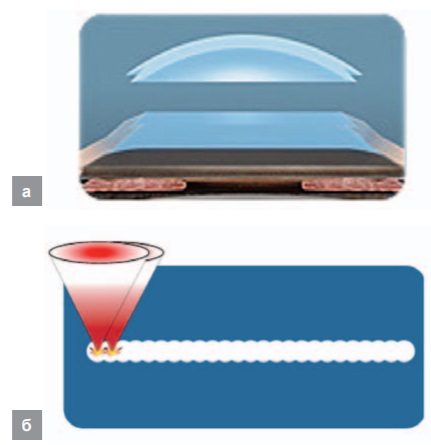
Рис. 12. Формирование разреза в роговице (а), формирование роговичного трансплантата и посадочного места для него при лечении бельма (б)
Fig. 12. Formation of the incision in the cornea (a); formation of the corneal graft and a recipient bed for it when treating the corneal leucoma (б)
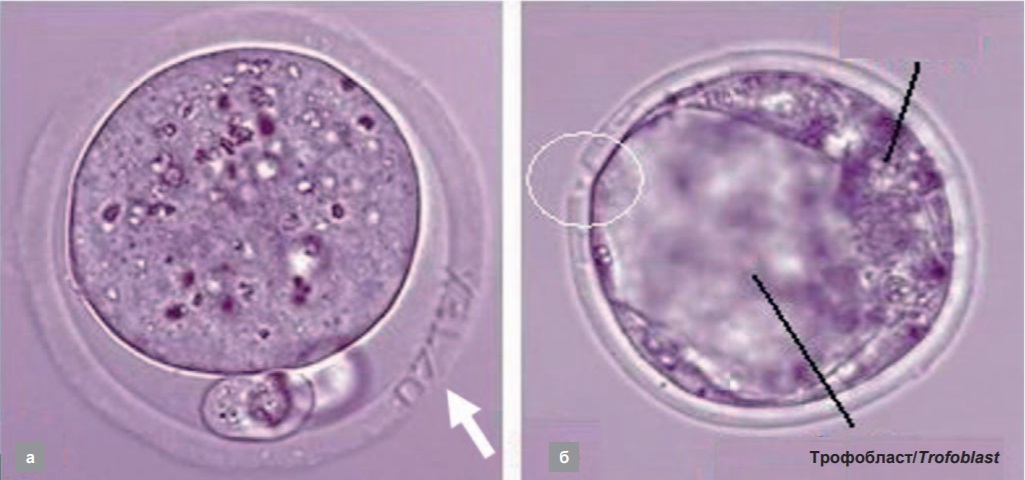
Рис. 13. Использование лазерного излучения: а – для нанесения маркировки на оболочку яйцеклетки (стрелка), б – для перфорации оболочки для облегчения выхода эмбриона (обведено белой линией)
Fig. 13. Laser light applied: a – for marking the ovocyte membrane (arrow), б – for perforation of the membrane to facilitate the embryo exit (in circle)

Рис. 14. Вклад линий в суммарную мощность излучения
Fig. 14. Contribution of lines to the summarized irradiation power
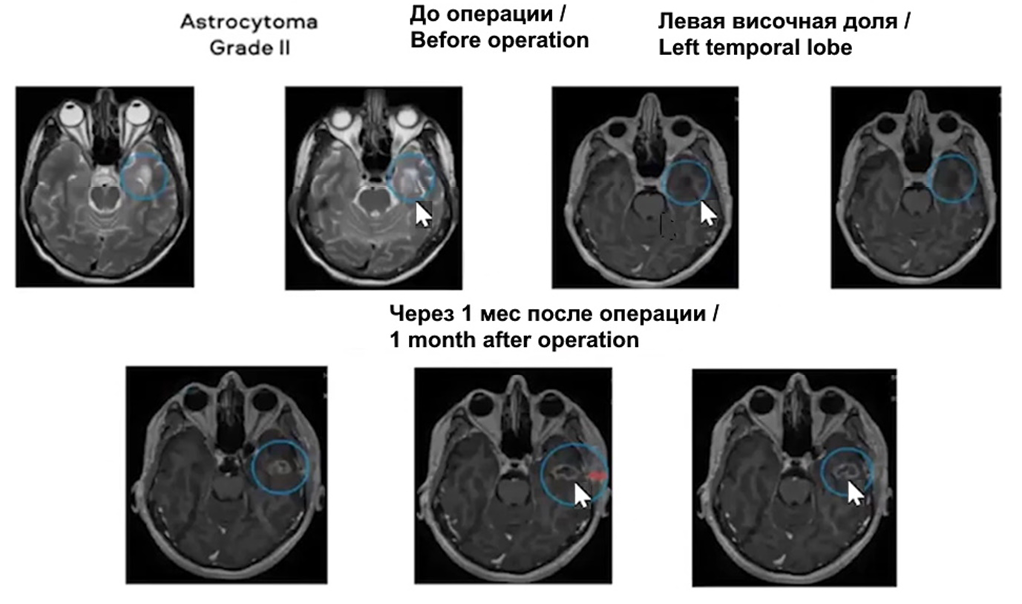
Рис. 15. Результат лечения опухоли головного мозга методом ЛИТТ. Стрелка показывает место локализации опухоли до и после лечения
Fig. 15. Outcomes of LITT treatment of the brain tumor. The arrow shows the site of the tumor before and after treatment
Вместе с тем при использовании этой методики остро встает вопрос контроля процесса воздействия в процессе операции. В этом направлении за последнее десятилетие произошел заметный прогресс. Разработаны совершенные нейронавигационные установки, позволяющие осуществить 3D-планирование вмешательства и эффективный контроль воздействия в реальном времени. Одним из таких эффективных средств является нейронавигационная система Stealth Station TREON Plus® (Medtronic, США). С использованием этой системы в ПСПбГМУ им. акад. И.П. Павлова достигнуты серьезные успехи в использовании лазерной интерстициальной терапии для лечения глиальных опухолей мозга.
На рисунке 15 представлены томограммы результатов лечения опухоли мозга [22]. Операция выполнялась через небольшое отверстие с использованием излучения с длиной волны 0,97 мкм, при этом наблюдалось образование зоны термодеструкции размером около 12 мм.
Всего к моменту доклада было проведено лечение 31 пациента. Использовались параметры воздействия, отработанные на мозге кроликов.
Необходимо заметить, что использование излучения, сильно поглощаемого гемоглобином, может приводить к карбонизации области, прилегающей к месту выхода излучения из световода, что приведет к изменению характера воздействия и «схлопывания» нагреваемой области.
В этом смысле представляется перспективным использование излучения с длиной волны 1,68 мкм [23], поглощаемого в основном водой. Как показали проведенные исследования, такое излучение может обеспечить прогрев больших объемов биоткани без наступления карбонизации [24].
Приведенные примеры не исчерпывают всех достижений в области использования лазерного излучения в медицине, но убедительно показывают, что прогресс в области лазерных медицинских аппаратов и технологий на их основе продолжается.
Список литературы
1. Минаев В.П. Лазерные аппараты для хирургии и силовой терапии: вчера, сегодня, завтра. Лазерная медицина. 2012; 16 (3): 57–65.
2. Привалов В.А., Крочек И.В., Лаппа А.В. Лазерная остеоперфорация в лечении остеомиелита. Челябинск: Изд-во «Челябинская ГМА»; 2010: 272.
3. Abushkin I.A., Privalov V.A., Lappa A.V., et al. Fiber 1.56- 1.9 μm lasers in treatment of vascular malformations in children and adults. Proc. SPIE 8565, Photonic Therapeutics and Diagnostics IX. 2013; 8565. DOI: 10.1117/12.2003405
4. Pinto M., Kikuchi R., Lyra L., et al. Endovenous laser ablation of the great saphenous vein comparing 1920-nm and 1470- nm diode laser. Int Angiol. 2016; 35 (6): 599–604.
5. Улупов М.Ю. Применение полупроводниковых и волоконных лазеров при болезнях уха, горла и носа. IX Петербургский форум отоларингологов России. СПб., 2020.
6. Ларин С.В., Винниченко А.А., Филипповский Д.В. и др. Аппарат медицинский «Fiberlase U1»/«Уролаз» для проведения малоинвазивного хирургического вмешательства. Лазер-информ. 2018; (11–12): 1–4.
7. Старцева Е.Д., Коваленко А.А., Андреева В.А. и др. Аппарат лазерный “FiberLase U2” для контактной литотрипсии. Лазер-информ. 2019; (11): 4–6.
8. Minaev V.P., Minaev N.V., Yusupov V.I., et al. Laser-induced hydrodynamic effect in urological operations. International Conference ALT’19, Praque, Czech Republic; 2019.
9. Минаев В.П., Минаев Н.В., Юсупов В.И. и др. Эффект лазерно-индуцированного гидродинамического рассечения биоткани в оперативной урологии. Квантовая электроника. 2019; 49 (4): 404–408.
10. Isner J.M. Blood. In: Isner J.M., Clarke R. (eds). Cardiovascular Laser Therapy. New York: Raven Press, Ltd; 1989.
11. Lekarev V., Dymov A., Vinarov A., et al. Mechanism of lithotripsy by superpulse thulium fiber laser and its clinical efficiency. Appl Sci. 2020; 10 (21): 7480. DOI: 10.3390/app10217480
12. Мартов А.Г., Дутов С.В., Попов С.В. и др. Микроперкутанная лазерная нефролитотрипсия. Урология. 2019; (2): 76–83. DOI: 10.18565/urology.2019.2.00-00
13. Kolegov A.A., Lappa A.V., Sofienko G.S., et al. Thulium-doped fiber lasers with direct pumping. Medical perspectives. 6th International A.M. Prokhorov Symposium on Lasers in Medicine and Biophotonics ICLO, St.-Petersburg, Russia; 2020.
14. Сурин А.А., Борисенко Т.Е., Стирманов Ю.С. и др. Линейка мощных непрерывных лазеров видимого диапазона VLM с мощностью излучения от 1,5 до 20 Вт в диапазоне 513–730 нм. Лазер-информ. 2018; 11–12 (626–627): 5–8.
15. Larionov I.A., Gulyashko A.S., Alekseev D.A., et al. High-efficient DFG of fiber lasers radiation in the spectral region of 3-um for soft tissue ablation. 6th International A.M. Prokhorov Symposium on Lasers in Medicine and Biophotonics ICLO, St.-Petersburg, Russia; 2020.
16. Niemz M.H. Laser-tissue interactions. Springer-Verlag Berlin Heidelberg, 2007: 322.
17. ООО «ОптоСистемы». URL: https://microscan.ru/femtovisum/#operations
18. Вартапетов С.К. Лазерное оборудование для офтальмологии. Доклад на научно-практическом семинаре. Выставка «Фотоника – мир лазеров и оптики, 2010», Москва; 2010.
19. Ильина И.В., Храмова Ю.В., Филатов М.А. и др. Новые технологии с применением фемтосекундного лазерного скальпеля для вспомогательных репродуктивных технологий. Сборник тезисов VII Троицкой конференции с международным участием «Медицинская физика» (ТКМФ-7). 19–21 октября 2020 г., Москва. М.: Изд-во ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет); 2020: 133–134.
20. Haglund R.F. Applications of free electron lasers in biological sciences, medicine and material science. In: Dubowski J.J., Tanev S. (eds). Photon-based Nanoscience and Nanobiotechnology. 2006: 175–203.
21. Солдатов А.Н. Многоволновые лазеры с наносекундной длительностью импульсов генерации в парогазовых активных средах. Физика. 2010; 53 (2/5): 91–100.
22. Острейко О.В., Михайлова Н.В., Новак В.Д. Малоинвазивная лазерная термохирургия глиальных опухолей головного мозга: клинико-экспериментальные корреляции. Сборник тезисов VII Троицкой конференции с международным участием «Медицинская физика» (ТКМФ-7). 19–21 октября 2020 г., Москва. М.: Изд-во ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет); 2020: 155–166.
23. Minaev V.P., Samartsev I.E., Tezadov Y., et al. Raman laser with wavelength 1.68 μm for medical applications. 5th International Symposium “Fiber Lasers and Their applications”. Saint Petersburg; 2010.
24. Dymov A.M., Kovalenko A.A., Vinarov A.Z., et al. 1.56 and 1.68 fiber lasers – possible instrument for LITT in urology. Preliminary results. 4th International Symposium “Lasers in Medicine and Biophotonics”. Saint Petersburg; 2016.
Об авторе
В. П. МинаевРоссия
Минаев Владимир Павлович – кандидат технических наук, главный научный сотрудник отдела лазерных технологий в медицине
г. Фрязино
Рецензия
Для цитирования:
Минаев В.П. 2011–2021 – еще 10 лет развития лазерной медицинской техники и технологий. Лазерная медицина. 2021;25(2):63-74. https://doi.org/10.37895/2071-8004-2021-25-2-63-74
For citation:
Minaev V.P. 2011-2021 – Ten more years of development of laser medical equipment and technologies. Laser Medicine. 2021;25(2):63-74. (In Russ.) https://doi.org/10.37895/2071-8004-2021-25-2-63-74
JATS XML


























