Перейти к:
Возможности оценки эффективности фотосенсибилизаторов на основе определения пороговых доз, вызывающих гемолиз эритроцитов
https://doi.org/10.37895/2071-8004-2021-25-2-41-47
Аннотация
Введение. В статье описана методика определения эффективности фотосенсибилизаторов порфиринового ряда на основе подбора их концентрации, вызывающих гемолиз эритроцитов (порог гемолиза). Порог гемолиза определяется при условиях: облучение в полосе Соре при стандартных параметрах – плотность мощности, экспозиционная доза, время облучения.
Материалы и методы. Фототерапевтический аппарат на базе лазерных диодов «АСТ» (ООО «Панков-медикл»), с выходной мощностью 0,5 Вт, длиной волны ≈ 405 нм. Эритроциты крови крыс. Аппарат Multiscan MS производства фирмы Labsystems, Финляндия. Препарат «Димегин», производное гематопорфирина, препарат «Фотодитазин» (ООО «ВЕТА-ГРАНД»), производное хлорина Е6.
Результаты. Анализ результатов на примере этих препаратов показал высокую эффективность предложенной методики. При облучении в полосе Соре выяснилось, что исследуемые фотосенсибилизаторы по эффективности не уступают друг другу.
Заключение. Методика является простой в исполнении и может быть применена для оценки эффективности различных фотосенсибилизаторов, что облегчит подбор их необходимых концентраций при терапии различных заболеваний.
Ключевые слова
Для цитирования:
Алексеев Ю.В., Миславский О.В., Дуванский В.А., Дуванский Р.А., Дроздова Н.В. Возможности оценки эффективности фотосенсибилизаторов на основе определения пороговых доз, вызывающих гемолиз эритроцитов. Лазерная медицина. 2021;25(2):41-47. https://doi.org/10.37895/2071-8004-2021-25-2-41-47
For citation:
Alekseev Yu.V., Mislavsky O.v., Duvanskiy V.A., Duvanskiy R.A., Drozdova N.V. Assessment of the photosensitizer efficacy after determination of threshold doses initiating erythrocyte hemolysis. Laser Medicine. 2021;25(2):41-47. (In Russ.) https://doi.org/10.37895/2071-8004-2021-25-2-41-47
ВВЕДЕНИЕ
Изучение биологического действия фотосенсибилизаторов (ФС) с облучением терапевтическими лазерными источниками необходимо рассматривать в прикладном аспекте в доклинических исследованиях.
Эффективность ФС можно оценивать по различным критериям, таким как их физико-химический свойства (фотостабильность, интенсивность флуоресценции, эффективность генерации синглетного кислорода и т. д.) [1]. Эти критерии очень важны для последующего производства и определения перспектив применения ФС.
Однако они не позволяют определить степень воздействия на биологические мишени. Оценка эффективности ФС на биологических объектах in vitro (клетки водорослей, микроорганизмы, культуры клеток различных тканей, в том числе и опухолевых) дает возможность более полно оценить ожидаемые от них эффекты in vivo, подобрать необходимые концентрации препаратов и параметры облучения, провести их скрининг для дальнейшего клинического применения [2–9]. В наше время уже имеются ФС различных классов (синтетические ФС, такие как фталоцианины, производные гематопорфирина, хлорина Е6, бактериохлоринов и т. д.), которые успешно применяются в клинике. В связи с расширением практики применения фотодинамической терапии (ФДТ) продолжается поиск и разработка все новых и новых ФС с улучшенными качествами для лечения онкологических и неонкологических заболеваний [10–13].
Также продолжается поиск новых источников излучения в спектре действия этих ФС. Надо учитывать, что дальнейшее развитие медицины будет связано с развитием нанотехнологий, и это будет отражаться на способах воздействия на биологические мишени при патологических процессах и способах доставки лекарственных веществ к этим мишеням. Таким образом, фотодинамическое воздействие в перспективе будет осуществляться как на уровне целого организма, так на органном, тканевом, клеточном и, возможно, молекулярном уровнях. Для этого требуется использовать фотосенсибилизаторы и мощность излучения применяемых источников с оценкой безопасных и эффективных параметров.
Можно проводить оценку сравнительной эффективности ФС и при клиническом применении с помощью лазерной биофотометрии, капилляроскопии, флуоресцентной спектроскопии (в том числе оценивается и степень снижения флуоресценции в процессе ФДТ), а также фотоплетизмографии и лазерной допплеровской флуоресценции по измерению кровотока [14–17]. Но нет сомнений, что оценка эффективности имеет наибольший смысл в доклинических исследованиях, что позволяет определить наиболее подходящие и безопасные методики ФДТ. Это не отменяет учет критериев сравнения уже используемых ФС для каждой нозологической формы.
Работами отечественных исследователей показано, что эритроциты крови являются эффективным объектом оценки ФС по их гемолитической активности, так как последние имеют тропность к клеточным мембранам [18–21]. Мы предлагаем использовать гемолитическую модель действия фотосенсибилизаторов в качестве биологического эквивалента фотодинамического воздействия в упрощенном варианте. Таким образом, можно сравнительно оценивать необходимые дозы облучения и количество ФС по их воздействию на гемолиз эритроцитов, то есть эти параметры можно принять за биологическую единицу фотодинамического действия. При этом эквивалент этих параметров можно переносить на различные длины волн в зависимости от спектра их поглощения, так как речь идет в основном о фотосенсибилизаторах порфиринового ряда, у которых максимум поглощения приходится на полосу Соре.
Нами предложено определение концентрации ФС, являющейся пороговой для начала гемолиза эритроцитов, которая фиксируется измерением оптической плотности продуктов гемолиза эритроцитов (выход гемоглобина) [22].
Для этого нужен стандартный источник излучения со стандартной мощностью и плотностью облучения в диапазоне 390–410 нм (полоса Соре).
Цель нашего исследования: подтверждение эффективности пороговой дозы гемолиза эритроцитов при воздействии на различные ФС.
В качестве примера, подтверждающего эффективность данной методики, нами произведена оценка фотодинамического эффекта производного гематопорфирина – водорастворимая соль 2,4-ди-(альфа-метоксиэтил)-дейтеропорфирина-IX (Димегина) (рис. 1) и производного хлорина Е6 (Фотодитазина).
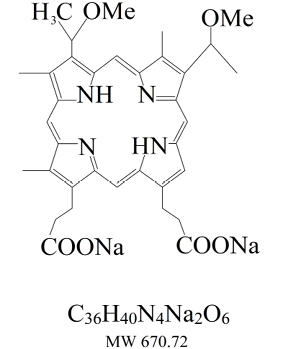
Рис. 1. Формула Димегина
Fig. 1. Dimegin formula
Димегин предназначен для лечения онкологических и неонкологических заболеваний, но пока не прошел клинических испытаний. В то же время препарат Фотодитазин разрешен для клинического применения (производство ООО «ВЕТА-ГРАНД»). Оба препарата имеют также спектры поглощения в применяемом в широкой клинической практике красном диапазоне: Димегин – 625–630 нм, Фотодитазин – 650–660 нм.
МАТЕРИАЛЫ И МЕТОДЫ
В исследовании применялся аппарат фототерапевтический на базе лазерных диодов «АСТ» производства ООО «Панков-медикл», с выходной мощностью 0,5 Вт и длиной волны ≈ 405 нм. Эксперимент проводился на эритроцитах крови, взятой из подъязычной вены у крыс самцов массой 400–450 г. Брали 1 мл крови в мерную пробирку, содержащую 3 мл физиологического раствора. Далее осаждали эритроциты на центрифуге, удаляли тромб и отмывали. Отмытые эритроциты разводили физиологическим раствором до оптической плотности 0,6–0,7, измеряемой с помощью аппарата Multiscan MS (Labsystems, Финляндия). В пластиковую чашку диаметром 57 мм, высотой 14 мм к 1 мл взвеси разведенных эритроцитов добавляли 1 мл Димегина, растворенного в физиологическом растворе в одном эксперименте, а в другом эксперименте – 1 мл Фотодитазина в физиологическом растворе. Контролями в данной работе служили: 1) взвесь эритроцитов в физиологическом растворе без облучения, 2) взвесь эритроцитов в физиологическом растворе с облучением. Экспериментальные образцы: 3) взвесь эритроцитов в физиологическом растворе с добавлением раствора Димегина (или Фотодитазина) с облучением. Объем экспериментальной смеси составлял 2 мл с концентрацией ~ 7 × 106 клеток в 1 мл. Облучение проводили с экспозиционной дозой 1,2 Дж/см2, в течение 1 мин с расстояния 5 см. Площадь облученной поверхности равнялась 25,5 см2. Регистрацию оптической плотности вели до облучения и после облучения через 1, 5, 10, 20, 30 и 40 минут.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Результатом проведенного исследования явилось то, что были определены концентрации Димегина и Фотодитазина (рис. 2, 3), не вызывающие гемолиза эритроцитов, которые соответствовали значению 0,975 мкг/мл. Концентрации Димегина и Фотодитазина, при которых наблюдалось проявление гемолиза суспензии эритроцитов, составляли 1,95 мкг/мл. На рисунках 4 и 5 видно, что на 10-й минуте после воздействия облучения совместно с фотосенсибилизаторами, происходит уменьшение оптической плотности по сравнению с контролями 1 и 2, которое свидетельствует о начале гемолиза суспензии эритроцитов.
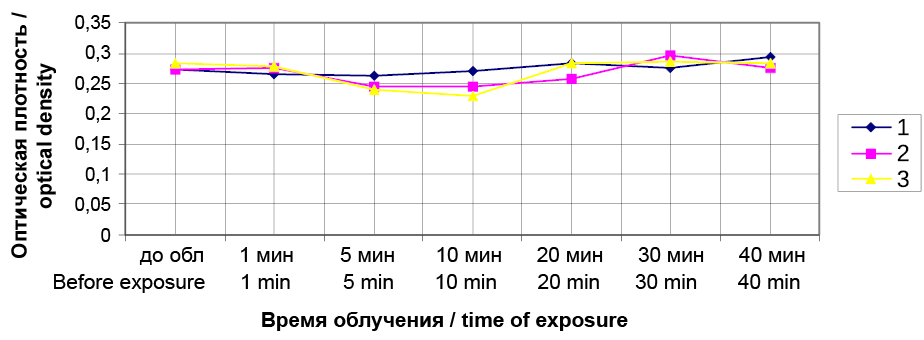
Рис. 2. Динамика фотогемолиза суспензии эритроцитов при воздействии Димегина в дозе 0,975 мкг/мл с облучением при длине волны 405 нм и с облучением без Димегина, измеряемая по оптической плотности при 690 нм. 1 – контрольный образец, взвесь эритроцитов в физиологическом растворе без облучения, 2 – контрольный образец, взвесь эритроцитов в физиологическом растворе с облучением, 3 – экспериментальный образец, взвесь эритроцитов в физиологическом растворе с добавлением раствора Димегина с облучением
Fig. 2. Dynamics of photohemolysis of erythrocyte suspension when exposed to Dimegin at dose 0.975 μg/ml with irradiation at 405 nm and with irradiation without Dimegin, measured by the optical density at 690 nm. 1 – control sample, erythrocyte suspension in the saline solution without irradiation, 2 – control sample, erythrocyte suspension in the saline solution with irradiation, 3 – experimental sample, suspension of erythrocytes in the saline solution with added Dimegin solution with irradiation
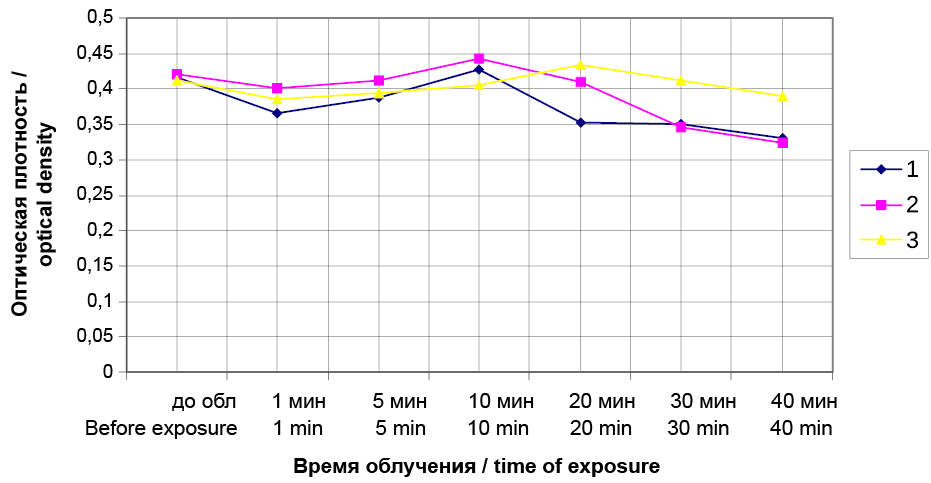
Рис. 3. Динамика фотогемолиза суспензии эритроцитов при воздействии Фотодитазина в дозе 0,975 мкг/мл с облучением при длине волны 405 нм и с облучением без Фотодитазина, измеряемая по оптической плотности при 690 нм. 1 – контрольный образец, взвесь эритроцитов в физиологическом растворе без облучения, 2 – контрольный образец, взвесь эритроцитов в физиологическом растворе с облучением, 3 – экспериментальный образец, взвесь эритроцитов в физиологическом растворе с добавлением раствора Фотодитазина с облучением
Fig. 3. Dynamics of photohemolysis of erythrocyte suspension when exposed to 0.975 μg/ml Photoditazine with irradiation at 405 nm and with irradiation without Photoditazine, measured by optical density at 690 nm. 1 – control sample, erythrocyte suspension in the saline solution without irradiation, 2 – control sample, erythrocyte suspension in the saline solution with irradiation, 3 – experimental sample, suspension of erythrocytes in the saline solution with added Photodetazine solution with irradiation
Изначальным маточным раствором для исследования фотогемолиза Димегина и Фотодитазина являлся раствор 1 мг/мл (1000 мкг/мл), который разводили в два раза, получая следующие концентрации: 500, 250, 125, 62,5, 31,25, 15,62, 7,81, 3,9, 1,95, 0,975 мкг/мл. В качестве стартовой концентрации использовали концентрацию 125 мкг/мл, которая приводила к фотогемолизу суспензии эритроцитов, не приводя к сильному изменению окраски самой суспензии. Концентрацией, вызывающей эффективный фотогемолиз, для Димегина и Фотодитазина являлась концентрация 31,25 мкг/мл, после которой шло постепенное уменьшение эффективности фотогемолиза суспензии эритроцитов, определяемое показателями оптической плотности.
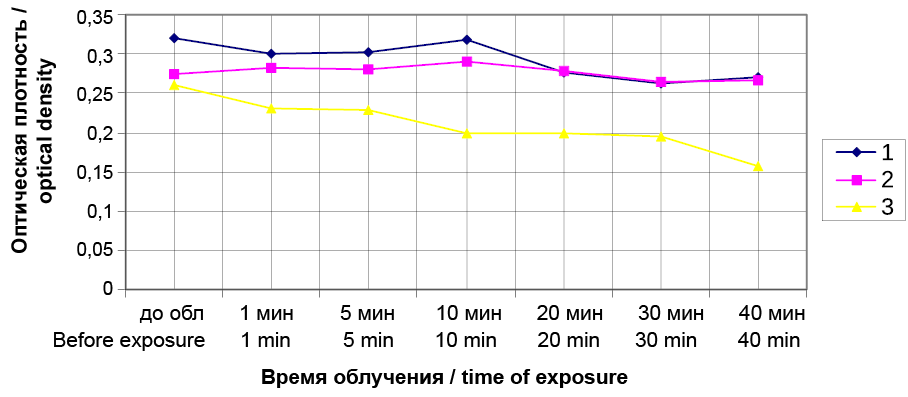
Рис. 4. Динамика фотогемолиза суспензии эритроцитов при воздействии Димегина в дозе 1,95 мкг/мл с облучением при длине волны 405 нм и с облучением без Димегина, измеряемая по оптической плотности при 690 нм. 1 – контрольный образец, взвесь эритроцитов в физиологическом растворе без облучения, 2 – контрольный образец, взвесь эритроцитов в физиологическом растворе с облучением, 3 – экспериментальный образец, взвесь эритроцитов в физиологическом растворе с добавлением раствора Димегина с облучением
Fig. 4. Dynamics of photohemolysis of erythrocyte suspension when exposed to Dimegin at dose of 1.95 μg/ml with irradiation at wavelength 405 nm and with irradiation without Dimegin, measured by optical density at 690 nm. 1 – control sample, erythrocyte suspension in the saline solution without irradiation, 2 – control sample, erythrocyte suspension in the saline solution with irradiation, 3 – experimental sample, suspended erythrocytes in the saline solution with added Dimegin solution with irradiation
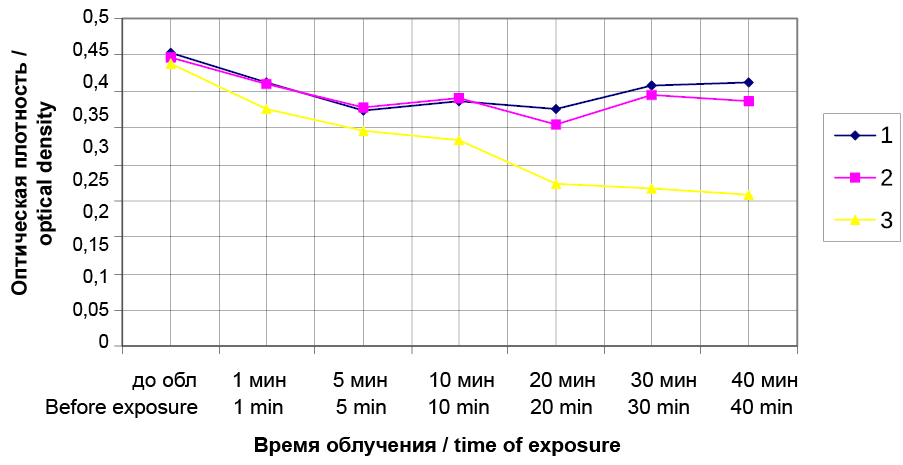
Рис. 5. Динамика фотогемолиза суспензии эритроцитов при воздействии Фотодитазина в дозе 1,95 мкг/мл с облучением при длине волны 405 нм и с облучением без Фотодитазина, измеряемая по оптической плотности при 690 нм. 1 – контрольный образец, взвесь эритроцитов в физиологическом растворе без облучения, 2 – контрольный образец, взвесь эритроцитов в физиологическом растворе с облучением, 3 – экспериментальные образец, взвесь эритроцитов в физиологическом растворе с добавлением раствора Фотодитазина с облучением
Fig. 5. Dynamics of photohemolysis of erythrocyte suspension when exposed to Photoditazine at dose 1.95 μg/ml with irradiation at wavelength 405 nm and with irradiation but without Photoditazine, measured by optical density at 690 nm. 1 – control sample, erythrocyte suspension in the saline solution without irradiation, 2 – control sample, erythrocyte suspension in the saline solution with irradiation, 3 – experimental sample, erythrocyte suspension in the saline solution with added Photoditazine solution with irradiation
ЗАКЛЮЧЕНИЕ
Предлагаемый метод исследования эффективности фотосенсибилизаторов порфиринового ряда является сравнительно простым и информативным. Оценивая эффективность исследуемых веществ с облучением в полосе Соре и зная их спектральные характеристики, можно оценить их эффективность и в других диапазонах длин волн по соотношению пиков поглощения. Метод подходит для стандартизации подобных препаратов. Полученные данные можно размещать в качестве справочной информации в каталогах для удобства при сравнении разных фотосенсибилизаторов. Возможно, вещества с известными молекулярными формулами будут модифицированы для усиления генерации синглетного кислорода с облучением определенными длинами волн. Таким образом, можно будет определять фотогемолиз при их оптимальных концентрациях.
Список литературы
1. Дадеко А.В. Исследование фотофизических свойств димегина как фотосенсибилизатора для фотодинамической терапии и флуоресцентной диагностики: автореф. дисс. ... канд. физ.-мат. наук. СПб.; 2018.
2. Козел Н.В., Шалыго Н.В. Способ оценки фототоксичности фотосенсибилизатора. Патент на изобретение BY 15504 C1, 28.02.2012. Заявка № 20081283 от 13.10.2008.
3. Якубовская Р.И., Плютинская А.Д., Лукьянец Е.А. Сравнительное изучение фотосенсибилизаторов различных классов в системе in vitro. Фталоцианины. Российский биотерапевтический журнал. 2014. 13 (4): 65–72.
4. Макарова Е.А., Якубовская Р.И., Ворожцов Г.Н., Ластовой А.П., Лукьянец Е.А., Морозова Н.Б., Плотникова Е.А. Фотосенсибилизатор для фотодинамической терапии. Патент на изобретение RU 2549953 C2, 10.05.2015. Заявка № 2013157611/15 от 25.12.2013.
5. Бондаренко В.М., Алексеев Ю.В., Миславский О.В., Пономарев Г.В. Перспективы применения динатриевой соли 2,4-ди(1-метоксиэтил)-дейтеропорфирина-IX («димегина») для фотодинамической терапии неонкологических заболеваний. Биомедицинская химия. 2014; 60 (3): 338–347.
6. Mishchenko Т.А., Mitroshina Е.V., Turubanova V.D., Alzeibak R., Balalaeva I.V., Vedunova М.V., et al. Effect of photosensitizers Photosens, Photodithazine and Hypericin on glioma сells and primary neuronal cultures: A comparative analysis. Modern Technologies in Medicine. 2019; 11 (4): 52–63. DOI: 10.17691/stm2019.11.4.06
7. Jori G., Brown S.B. Photosensitized inactivation of microorganisms. Photochem Photobiol Sci. 2004; (3): 403–405. DOI: 10.1039/b311904c
8. Nitzan Y., Gutterman М., Malik Z., Ehrenberg В. Inactivation of gram-negative bacteria by photosensitized porphyrins. Photochem Photobiol. 1992; 55 (1): 89–96. DOI: 10.1111/j.1751-1097.1992. tb04213.x
9. Плотникова Е.А., Грин М.А., Островерхов П.В., Пантюшенко И.В., Якубовская Р.И., Каприн А.Д. Первичный скрининг субстанций-фотосенсибилизаторов бактериохлоринового ряда для фотодинамической терапии злокачественных новообразований. Биомедицинская химия. 2018; 64 (3): 283–289. DOI: 10.18097/PBMC20186403283
10. Странадко Е.Ф. Основные этапы развития фотодинамической терапии в России. Фотодинамическая терапия и фотодиагностика. 2015; 4 (1): 3–10. DOI: 10.24931/2413-9432-2015-4-1-3-10
11. Филоненко Е.В., Серова Л.Г. Фотодинамическая терапия в клинической практике. Biomedical Photonics. 2016; 5 (2): 26–37.
12. Дуванский В.А., Попова Е.А. Первый опыт применения фотодинамической терапии в комплексном лечении дуоденальных язв. Лазерная медицина. 2004; 8 (3): 217.
13. Abrahamse H., Hamblin M.R. New photosensitizers for photodynamic therapy. Biochem J. 2016; 473(4): 347–364. DOI: 10.1042/BJ20150942
14. Douvansky V.A., Kniazev M.В. Autofluorescent endoscopic diagnostics of epithelial neoplasms in the colon. Journal of Gastroenterology and Hepatology. 2015; 30 (4): 211.
15. Князев М.В., Дуванский В.А. Аутофлуоресцентная эндоскопия в диагностике колоректальных неоплазий. Эндоскопическая хирургия. 2014; (1): 186.
16. Макарова Ю.Б. Диагностика хронических воспалительных заболеваний кожи и оценка эффективности их терапии с помощью метода лазерной биофотометрии: автореф. дисс. ... канд. мед. наук. Тула; 2007.
17. Алексеев Ю.В., Лихачева Е.В., Терешкин Д.В., Пономарев Г.В., Мазур Е.М. Подбор эффективных фотосенсибилизаторов для лечения заболеваний ЛОР-органов на основе изучения их накопления в патологически измененных тканях. Биомедицинская химия. 2012; 58 (1): 112–120. DOI: 10.18097/pbmc20125801112
18. Мансурова Г.В., Погребная О.Г., Пономарев Г.В., Решетников А.В., Потапенко А.Я., Бездетная Л.Н. и др. Фотогемолиз, сенсибилизированный производными дейтеропорфирина-IX: определение прочности связывания красителей с эритроцитами. Биофизика. 2003; 48 (2): 251–255.
19. Ларина Н.А. Исследование индуцированных продуктами фотоокисления фуракумаринами гемолиза эритроцитов человека и супрессии реакции контактной чувствительности у мышей: дисс. ... канд. мед. наук. М.; 2001: 23–35.
20. Cook J.C. Some characteristics of hemolysis by ultraviolet light. J Cell Comp Physiol. 1956; 47 (1): 55–84. DOI: 10.1002/jcp.1030470105
21. Мансурова Г.В. Скрининг гемолитической и иммуносупрессорной активности фотосенсибилизаторов порфиринового ряда: автореф. дисс. ... канд. биол. наук. М.; 2007.
22. Алексеев Ю.В., Миславский О.В., Пономарев Г.В., Иванов А.В., Давыдов Е.В. Способ определения эффективности фотосенсибилизаторов и параметров лазерного излучения 1264 нм на основе порога гемолиза эритроцитов. Лазеры в науке, технике, медицине: Сборник научных трудов XXXI международной конференции. М.; 2020: 106–107.
Об авторах
Ю. В. АлексеевРоссия
Алексеев Юрий Витальевич – доктор медицинских наук, руководитель отделения экспериментальной лазерной медицины
г. Москва
О. В. Миславский
Россия
Миславский Олег Владимирович – кандидат фармацевтических наук, старший научный сотрудник лаборатории молекулярных механизмов аллергии; старший научный сотрудник отделения экспериментальной лазерной медицины
г. Москва
В. А. Дуванский
Россия
Дуванский Владимир Анатольевич – доктор медицинских наук, профессор, заместитель директора по научной работе, руководитель отделения эндоскопической хирургии; заведующий кафедрой эндоскопии, эндоскопической и лазерной хирургии
г. Москва
Р. А. Дуванский
Россия
Дуванский Роман Анатольевич – кандидат медицинских наук, ведущий научный сотрудник отделения эндоскопической хирургии; врач акушер-гинеколог
г. Москва
Н. В. Дроздова
Россия
Дроздова Наталья Владимировна – младший научный сотрудник отделения экспериментальной лазерной медицины
г. Москва
Рецензия
Для цитирования:
Алексеев Ю.В., Миславский О.В., Дуванский В.А., Дуванский Р.А., Дроздова Н.В. Возможности оценки эффективности фотосенсибилизаторов на основе определения пороговых доз, вызывающих гемолиз эритроцитов. Лазерная медицина. 2021;25(2):41-47. https://doi.org/10.37895/2071-8004-2021-25-2-41-47
For citation:
Alekseev Yu.V., Mislavsky O.v., Duvanskiy V.A., Duvanskiy R.A., Drozdova N.V. Assessment of the photosensitizer efficacy after determination of threshold doses initiating erythrocyte hemolysis. Laser Medicine. 2021;25(2):41-47. (In Russ.) https://doi.org/10.37895/2071-8004-2021-25-2-41-47
JATS XML


























