Перейти к:
Морфологические особенности процессов репарации ран при применении низкоинтенсивной лазерной терапии у больных синдромом диабетической стопы
https://doi.org/10.37895/2071-8004-2023-27-3-8-14
Аннотация
Цель: оценить морфологические особенности регенерации ткани нижних конечностей у пациентов с синдромом диабетической стопы после проведения низкоинтенсивной лазерной терапии.
Материалы и методы. В работе представлен сравнительный ретроспективный анализ гистологического материала тканей ран 125 пациентов с синдромом диабетической стопы (СДС). Материал для исследования – гистологические срезы ткани раневых дефектов, окрашенные гематоксилин-эозином. Изученный материал разделен на две группы: основную – 65 микропрепаратов ткани ран пациентов СДС, у которых на фоне традиционной терапии при лечении раневых дефектов применяли низкоинтенсивную лазерную терапию (НИЛТ); контрольную – 60 микропрепаратов тканей ран пациентов СДС, которым после проведения хирургической обработки проводилась стандартная комплексная терапия с местным лечением ран влажно-высыхающими повязками.
Результаты и обсуждение. Анализ полученных результатов показал, что НИЛТ способствует активации и увеличению количества клеточного состава: макрофагов, лимфоцитов, появлению фибробластов, более быстрому протеканию всех фаз регенераторного процесса, формированию грануляционной ткани и значительному уменьшению площади раневой поверхности по сравнению с группой пациентов, пролеченных традиционной комплексной методикой с местным лечением ран.
Заключение. Применение НИЛТ в комплексном лечении пациентов с гнойно-некротическими формами СДС может ускорять репаративные процессы в раневых дефектах, приводить к значительному сокращению их площади. Данная методика способствует скорейшему очищению ран, а также позволяет в более короткие сроки, чем при традиционном лечении, уменьшить или ликвидировать воспалительный процесс, стимулирует развитие грануляционной ткани и ускоряет процесс эпителизации
Для цитирования:
Багрий А.Э., Луценко Ю.Г., Сычёва Д.Р. Морфологические особенности процессов репарации ран при применении низкоинтенсивной лазерной терапии у больных синдромом диабетической стопы. Лазерная медицина. 2023;27(3):8-14. https://doi.org/10.37895/2071-8004-2023-27-3-8-14
For citation:
Bagry A.E., Lutsenko Yu.G., Sycheva D.R. Morphological features of wound repair processes under low-level laser therapy in patients with diabetic foot syndrome. Laser Medicine. 2023;27(3):8-14. (In Russ.) https://doi.org/10.37895/2071-8004-2023-27-3-8-14
ВВЕДЕНИЕ
На симпозиуме ВОЗ «Сахарный диабет» (Женева, 1987) синдром диабетической стопы (СДС) был определен как патологическое состояние стопы при сахарном диабете (СД), возникающее на фоне патологии периферических нервов и сосудов, проявляющееся в виде трофических язв, костно-суставных изменений и гнойно-некротических процессов [1]. В Международном соглашении по диабетической стопе (2000) было принято определение СДС как комплекса анатомо-функциональных изменений стопы у больного СД, связанного с диабетической нейропатией, ангиопатией, остеоартропатией, на фоне которых развиваются гнойно-некротические процессы [2]. Больные с диабетическими трофическими язвами стоп составляют 6–10 % всех госпитализированных лиц с СД, а срок их пребывания в стационаре на 60 % больше, чем у лиц без нарушений целостности кожных покровов [3]. К наиболее грозным последствиям, возникающим у пациентов с синдромом диабетической стопы (СДС), относится ампутация нижних конечностей. В настоящее время 50–70 % всех ампутаций нижних конечностей выполняется у больных СД [4]. Эффективность консервативного лечения больных сахарным диабетом с синдромом диабетической стопы не превышает 30 % [5]. Также одним из наиболее типичных и распространенных проявлений СДС является развитие хронических раневых дефектов нижних конечностей, приводящих к значительному снижению качества жизни пациентов, инвалидизации, высокому риску присоединения бактериальной флоры в некротизированных участках, развитию различных септических осложнений в случаях отсутствия своевременно подобранного хирургического и терапевтического лечения.
Независимо от типа и объема раны процесс заживления раневого дефекта включает в себя определенные, последовательные стадии: фазу воспалительных изменений, пролиферативную фазу, фазу эпителизации. При острых ранах в каждой из фаз все биологические и морфологические процессы протекают параллельно друг другу – в свою очередь, для хронического течения процесса, при длительно существующем раневом дефекте, характерном для СДС, хронология этапов заживления значительно нарушается. Хронические раны диабетической этиологии имеют тенденцию к длительной задержке в определенной фазе, значительно замедляя процесс регенерации [9]. При неосложненном течении продолжительность фазы воспаления занимает от 3 до 5 суток – происходит остановка кровотечения, элиминация некротического детрита, очищение раневого ложа. Основные типы клеток, находящиеся в участке воспаления в данную фазу – нейтрофилы (являются первой линий защиты, фагоцитируют чужеродные агенты), макрофаги (принимают активное участие в дальнейшем процессе элиминации некротического детрита, очищают раневое ложе и подготавливают его к пролиферативной фазе, синтезируют факторы роста), лимфоциты (выделяют лимфокины). У пациентов с СД повышенный уровень глюкозы значительно снижает лейкоцитарную активность, способность данного типа клеток своевременно мигрировать в зону воспаления и осуществлять фагоцитоз. Для пролиферативной фазы при неосложненном течении репаративного процесса характерно восстановления кровотока и заполнение раневого ложа новообразованной, молодой, хорошо васкуляризированной соединительной тканью, богатой клетками, бедной коллагеновыми волокнами – грануляционной тканью. Продолжительность данной фазы при неосложненных условиях занимает от 10 до 30 дней. Для формирования грануляционной ткани необходимо наличие в раневом ложе достаточного количества специализированных клеток – фибробластов. Данный тип клеток мигрирует в поврежденный участок под воздействием факторов роста, вырабатываемых макрофагами в фазу воспалительных изменений. Высокий уровень глюкозы в крови оказывает негативное влияние на способность фибробластов к миграции, а также значительно замедляет их пролиферацию – со временем развивается потеря чувствительности данного типа клеток к стимуляции факторами роста. Фаза эпителизации завершает процесс регенерации и является самой продолжительной – до 50–60 суток, даже при неосложненном течении. Для инициации этой фазы необходимы условия, которые могли бы обеспечить процесс миграции клеточного состава из краев в центр раневого дефекта. Миграция клеток возможна по ровной, однородной поверхности – данные условия реализуются только в случае полного заполнения дефекта грануляционной тканью. В процессе эпителизации грануляционная ткань превращается в рубцовую – плотную волокнистую соединительную ткань, которая является морфологическим субстратом неполной репаративной регенерации.
У пациентов с СД хронические раневые дефекты находятся в фазе воспаления гораздо дольше, чем при ненарушенном углеводном обмене. При незавершенной, длительной фазе воспалительных изменений, истощении клеточного состава, наличии некротических масс в раневом дефекте отсутствуют необходимые условия для инициации фазы регенерации, активации фибробластов. Вследствие вышеуказанных морфологических особенностей не происходит синтез грануляционной ткани в достаточном количестве – отсутствуют необходимые для дальнейшей эпителизации условия.
Процесс репарации раневых дефектов у пациентов СДC значительно замедлен – из-за большого количества как клеточных, так и сосудистых нарушений. Заживление ран у пациентов СДС, особенно в случае присоединения вторичной бактериальной инфекции с образованием гнойного экссудата, характеризуется десинхронизацией фаз воспаления и регенерации, проявляющейся в пролонгировании воспалительных изменений на фоне макрофагальной реакции и расстройств микроциркуляции. Одновременно происходит торможение репаративного процесса, что приводит к возникновению длительно незаживающих ран [6]. Современный подход к хирургическому лечению пациентов СДС включает в себя не только традиционную комплексную терапию с местным лечением ран, но и разнообразные физические методы воздействия на некротизированные участки ткани. В ряде работ последних лет была доказана эффективность применения внутривенного лазерного облучения крови (ВЛОК) при лечении гнойно-некротических форм пациентов СДС [7]. В литературе имеются многочисленные упоминания о местном применении различных видов низкоинтенсивного лазерного излучения (НИЛИ) – в непрерывном режиме красного спектра (633–635 нм), в импульсном режиме инфракрасного спектра (ИК) (890–904 нм). Данный метод физического воздействия считается эффективным при лечении раневых дефектов пациентов СДС – способствует отторжению некротизированных участков ткани, активирует и ускоряет процесс регенерации. За счет неинвазивного освечивания НИЛИ восстанавливается эластичность мембран клеток, нормализуется лимфо- и гемомикроциркуляция в участке воздействия. Хронические раны пациентов СДС склонны к задержке в альтеративной и экссудативной фазах воспаления, значительному замедлению регенерации. В. И. Елисеенко [8] было показано, что процесс заживления лазерных ран характеризуется редукцией экссудативной фазы воспаления, что связано со стерилизацией раны за счет термического компонента лазерного воздействия, активной пролиферацией клеточных элементов макрофагального ряда, наличием минимальной нейтрофильной инфильтрации формирующейся грануляционной и окружающей ткани.
НИЛТ способствует ускорению и завершению процессов регенерации тканевого дефекта за счет стимуляции репарации поврежденной ткани, роста объема грануляций и краевой эпителизации, улучшения кровообращения в ране.
Основываясь на гистологической картине, можно определить особенности влияния НИЛТ на течение раневого процесса у пациентов СДС, сравнить с морфологической картиной репаративных изменений у пациентов контрольной группы – биопсийным материалом больных, которые были пролечены традиционным методом.
Цель работы: оценить морфологические изменения степени выраженности регенеративных процессов в тканях нижних конечностей у пациентов с синдромом диабетической стопы после проведения низкоинтенсивной лазерной терапии.
МАТЕРИАЛЫ И МЕТОДЫ
Проведен сравнительный ретроспективный анализ гистологического материала тканей ран 125 пациентов СДС, находившихся на стационарном лечении в специализированном хирургическом отделении ГБУ «ЦГКБ № 9 г. Донецка» за период 2020–2022 гг. Среди пациентов СДС было 53 % женщин и 47 % мужчин в возрасте от 22 до 90 лет с медианным значением 66 (61–73) лет. У всех больных установлен диагноз сахарный диабет I или II типа с длительностью заболевания 10–15 лет (min – до 1 года, max – 52 года). Объем поражения тканей стопы варьировал от II до III степени по классификации Wagner (II степень диагностирована в 54,6 % случаев). Основную группу составили 65 пациентов СДС, у которых на фоне традиционной терапии при лечении раневых дефектов применяли НИЛТ. Лазеротерапию проводили полупроводниковым лазером в инфракрасном диапазоне в импульсном режиме с длинной волны 0,89 мкм, с частотой 80 Гц, на зоны проекции крупных сосудов, на заднюю группу мыши голеней, бедер и раневой дефект. Количество зон воздействия за одну процедуру составляло от 2 до 4. Время экспозиции на одну зону – 128 с. Курс – 7–8 сеансов.
Группу контроля составили 60 пациентов с гнойно-некротическими формами диабетической стопы, которым после проведения хирургической обработки проводилась стандартная комплексная терапия с местным лечением ран влажно-высыхающими повязками с водным раствором хлоргексидина. Морфологическое исследование проводились на базе централизованного патолого-анатомического отделения Центральной городской клинической больницы № 1 города Донецка. Материал для гистологического исследования был представлен микропрепаратами ткани раневых дефектов нижних конечностей пациентов СДС – образцы фиксировались в 5 % растворе нейтрального формалина, заливались в парафиновые блоки.
Методом последовательных биопсий исследовали кусочки ткани из раневых дефектов с 1-х по 20-е сутки после операции. При световой микроскопии использовали окраску срезов гематоксилином и эозином, толуидиновым синим и по Ван Гизону. С помощью микроскопа «Micros MC 50», объектива «WF EWF 10х/18» были изучены морфологические особенности течения репаративного процесса в раневых дефектах пациентов СДС: клеточный состав и его степень выраженности, наличие или отсутствие некротически измененных фрагментов ткани, появление грануляций, особенности ангиогенеза. Для статистической обработки полученных данных использовалась программа Microsoft Excel.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Морфологическое исследование показало, что у больных основной группы после применения НИЛТ первые 3 суток в дне раневых дефектов 44 случаев определялась отечность жировой ткани, с выраженной в 42 случаях и умеренной в 12 случаях лейкоцитарной инфильтрацией, с наличием единичных макрофагов, гистиоцитов, моноцитов, фрагментов раневого детрита в 43 случаях. В прилежащих к ране тканях пациентов основной группы определялись расстройства микроциркуляции к началу 3-х суток: гемостаз в 31 случае, сладжи эритроцитов в сосудистом русле в 44 случаях, диапедезные периваскулярные кровоизлияния в 28 случаях, венозная гиперемия в 50 случаях, плазматическое пропитывание сосудистой стенки с явлением десквамации эндотелиоцитов в 22 случаях. У больных контрольной группы в течение первых 3 суток в раневых дефектах 56 случаев определялась выраженная отечность жировой ткани, в 12 случаях в жировой клетчатке наблюдалась гибель липоцитов, их фагоцитирование и появление макрофагов с ячеистой цитоплазмой, содержащей капли жира к концу 3-х суток. К началу 2-х суток у пациентов контрольной группы в дне раневых дефектов 55 случаев определялась выраженная лейкоцитарная инфильтрация, с единичными макрофагами, остатками раневого детрита и очаговым скоплением фибрина. В прилежащих к раневому дефекту тканях пациентов контрольной группы к началу 2-х суток также определялись расстройства микроциркуляции: в 15 случаях артериальная гиперемия, в 22 случаях – венозная гиперемия, очаговые кровоизлияния в 24 случаях, выраженная десквамация эндотелия в 33 случаях к концу 2-х суток, плазматическое пропитывание сосудистых стенок также в 33 случаях, набухание эндотелиальных клеток в 20 случаях, в 10 случаях к концу 2-х суток – агглютинация эритроцитов и формирование микротромбов.
Лейкоцитарная инфильтрация, с наличием большого количества лейкоцитарно-некротического детрита, визуализировалась в краях ран пациентов контрольной группы (после применения традиционной комплексной терапии с местным лечением ран) на 4-е сутки – в 35 случаях умеренная нейтрофильная инфильтрация сетчатого слоев дермы (рис. 1), в 25 случаях – слабовыраженная клеточная инфильтрация сосочкового слоя дермы (рис. 1). В раневых дефектах тканей материала пациентов основной группы (после применения НИЛТ) – в 55 случаях определялась умеренная лейкоцитарная инфильтрация на 3-и сутки, в 10 случаях – слабовыраженный нейтрофильный инфильтрат на 4-е сутки.
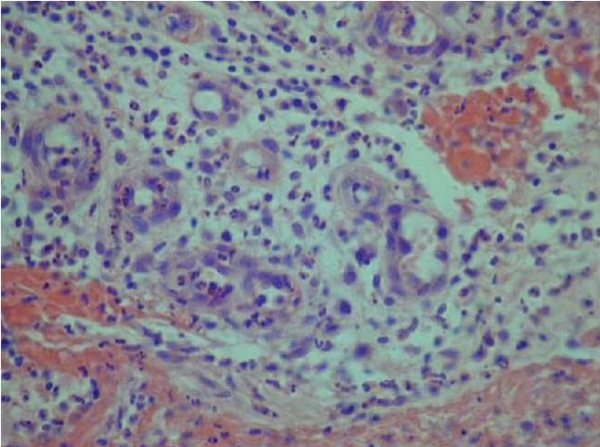
Рис. 1. Нейтрофильная инфильтрация сосочкового слоя дермы
у пациентов контрольной группы.
Окраска гематоксилином и эозином, ×400
Fig. 1. Neutrophil infiltration of the dermis papillary layer
in the control group of patients.
Staining with hematoxylin and eosin, ×400
В тканях раневых дефектов пациентов основной группы в 38 случаях лейкоцитарно-некротический детрит (ЛНД) отсутствовал на 5-е сутки, в 20 случаях –визуализировался в области краев раны к концу 5-х суток, в 7 случаях занимал все поле зрения на 5-е сутки. В тканях ран материала контрольной группы в 42 случаях ЛНД, с диффузной лейкоцитарной инфильтрацией, занимал все поле зрения к 6–7-м суткам, в 18 случаях – ЛНД визуализировался к концу 6-х суток на 1/2 площади поверхности поля зрения, с очаговой лейкоцитарной инфильтрацией. Лейкоцитарно-некротический детрит микроскопически идентифицировали по скоплению нейтрофилов, наличию некротически измененных пучков коллагеновых волокон (ПКВ), покрытых фибрином, диффузной лейкоцитарной инфильтрации (рис. 2). Фокусы некроза были представлены гомогенными, бесструктурными, безъядерными участками коллагеновых волокон.
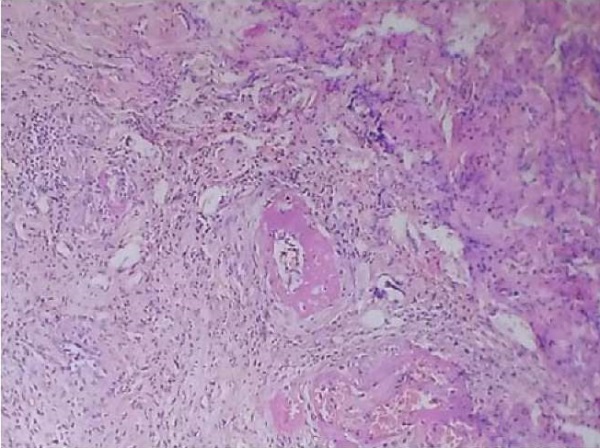
Рис. 2. Участок лейкоцитарно-некротического детрита в крае раны
у пациента контрольной группы на 6-е сутки.
Окраска гематоксилином и эозином, ×200
Fig. 2. A leukocyte-necrotic detritus area at the wound edge
in a patient from the control group on day 6.
Staining with hematoxylin and eosin, ×200
В сетчатом и сосочковом слоях дермы пациентов основной группы в 50 случаях определялась выраженная макрофагальная инфильтрация на 5-е сутки, с тенденцией к увеличению их количества в направлении от краев раны к центру, в 15 случаях – слабовыраженная инфильтрация макрофагами к концу 5-х суток. У пациентов контрольной группы в 35 случаях визуализировались единичные макрофаги в области краев раны на 6-е сутки, в 22 случаях – слабо выраженная макрофагальная инфильтрация, без тенденции к увеличению количества клеток от краев к центру раневого дефекта к концу 6-х суток, и только в 3 случаях – выраженная инфильтрация макрофагами на 6-е сутки. В краях ран 49 пациентов основной группы после применения 5 сеансов НИЛТ определялись небольшие скопления лимфоцитов в сосочковом слое дермы (рис. 3), в 11 случаях лимфоциты располагались периваскулярно в сетчатом слое к началу 4-х суток. В 5 случаях отмечалась тенденция к увеличению числа лимфоцитов от области дна раневого дефекта к периферическим участкам – с выраженной лимфоцитарной инфильтрацией данных зон к началу 6-х суток. У пациентов контрольной группы в 36 случаях визуализировались единичные лимфоциты в сосочковом слое дермы к концу 6-х суток, в 19 случаях определялась слабовыраженная лимфоцитарная инфильтрация сосочкового и сетчатого слоев дермы на 8-е сутки, в 5 случаях лимфоциты в обоих слоях дермы лимфоциты отсутствовали к 8–9-м суткам.

Рис. 3. Единичные нейтрофилы и мелкие группы лимфоцитов в сосочковом слое дермы.
Рана после 5 сеансов лазерного излучения.
Окраска гематоксилином и эозином, ×400
Fig. 3. Sporadic neutrophils and small groups of lymphocytes in the dermis papillary layer.
Wound after five LLLT sessions.
Staining with hematoxylin and eosin, ×400
У пациентов основной группы после применения 8 сеансов НИЛТ в 24 случаях отмечалось появление фибробластов (больше половины поля зрения), представленных компактными, веретенообразными клетками, окруженными тонкими пучками оксифильных коллагеновых волокон (рис. 4). В 23 случаях в тканях ран пациентов СДС основной группы фибробласты занимали 1/2 поля зрения к началу 10-х суток, в 18 случаях – все поле зрения на 11-е сутки. В 27 случаях к концу 13-х суток в области дна раневого дефекта пациентов контрольной группы определялись адвентициальные клетки – небольших размеров, веретеновидной уплощенной формы, располагались по ходу капилляров, занимали 1/4 поля зрения. В 23 случаях в ткани ран пациентов СДС контрольной группы фибробласты визуализировались в краях раневого дефекта – занимали 1/3 поля зрения к 13–14-м суткам, в 10 случаях отсутствовали как адвентициальные клетки, так и фибробласты на 13-е сутки.
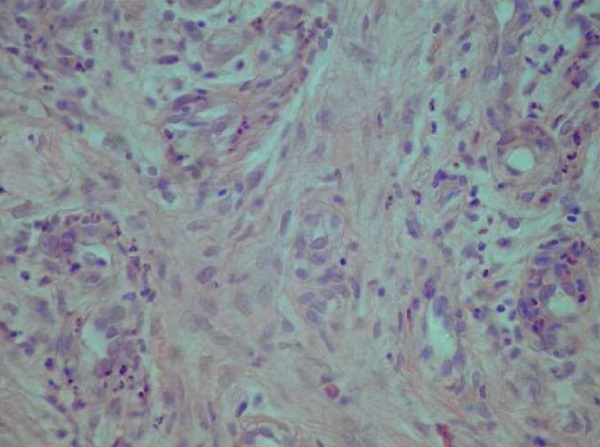
Рис. 4. Компактное скопление фибробластов,
окруженных тонкими пучками оксифильных коллагеновых волокон.
Рана после 8 сеансов лазерного излучения.
Окраска гематоксилином и эозином, ×400
Fig. 4. Clusters of fibroblasts surrounded by thin bundles of oxyphilic collagen fibers.
Wound after eight LLLT sessions.
Staining with hematoxylin and eosin, ×400
Более выраженное и активное разрастание грануляционной ткани, которая микроскопически была представлена тонкостенными капиллярами и недифференцированными клетками соединительной ткани, встречалось у 47 пациентов основной группы на 15–16-е сутки – в поле зрения определялась грануляционная ткань, полностью восполняющая раневой дефект, от сетчатого слоя дермы, до рогового слоя эпидермиса к концу 16-х суток, у 18 пациентов сформировалась только в дерме на 16-е сутки. У пациентов контрольной группы появление активных грануляций было менее выражено, с ограничением репаративного процесса зонами сетчатого и сосочкового слоев дермы – в 24 случаях к концу 19-х суток, только в сетчатом слое дермы – в 36 случаях на 18-е сутки.
Таким образом, результаты проведенных гистологических исследований показали, что применение такого метода физического воздействия как НИЛТ значительно ускоряет репаративные процессы в хронических ранах пациентов СДС – способствует более быстрому формированию грануляционной ткани и значительному уменьшению площади раневой поверхности по сравнению с группой пациентов, пролеченных традиционной комплексной методикой с местным лечением ран. НИЛТ-терапия благотворно влияет на количественные характеристики и клеточный состав каждой фазы регенераторного процесса: в фазу воспалительных изменений активирует миграцию лейкоцитов, увеличивает число макрофагов в раневых дефектах – за счет данных типов клеток происходит более быстрая элиминация лейкоцитарно-некротического детрита. НИЛТ оказывает стимулирующие действие на пролиферативную фазу – при изучении морфологии тканей ран пациентов СДС в проведенном исследовании микроскопически было обнаружено наличие большого количества активных фибробластов в раневых дефектах. Появлению активных фибробластов в тканях ран пациентов СДС после применения НИЛТ способствовало увеличение количества макрофагов и лимфоцитов, также обусловленное данным методом физического воздействия – макрофаги и лимфоциты, выделяют цитокины и факторы роста, потенцирующие коллагенсинтезирующую функцию фибробластов. На основании проведенного исследования можно сделать вывод, что после применения НИЛТ-терапии, по сравнению с традиционной комплексной методикой лечения, в сформировавшейся грануляционной ткани появляется большее количество зрелых, активных фибробластов и новообразованных тонкостенных сосудов, улучшается процесс васкуляризации – данные морфологические особенности играют важную роль в процессах дальнейшего, активного созревания грануляционной ткани (чем большая площадь поверхности раневого дефекта заполнена грануляциями, тем быстрее наступит финальная фаза эпителизации и заживление). Полученные результаты позволяют заключить, что применение лазерного излучения в комплексном лечении больных с гнойно-некротическими формами синдрома диабетической стопы способствует скорейшему очищению ран, сокращению площади раневых дефектов, позволяет в более короткие сроки, чем при традиционном лечении, уменьшить или ликвидировать воспалительный процесс, стимулирует развитие грануляционной ткани и ускоряет процесс эпителизации. Это позволяет сократить сроки и улучшить результаты лечения больных. НИЛТ можно отнести к перспективной, надежной и эффективной (что подтверждается результатами данного исследования) методике лечения раневых дефектов пациентов СДС за счет выраженной стимуляции процесса регенерации хронических ран.
ЗАКЛЮЧЕНИЕ
Применение низкоинтенсивной лазерной терапии положительно влияет на репаративные процессы хронических ран пациентов СДС – активирует процесс формирования грануляционной ткани, приводящий к значительному уменьшению площади раневой поверхности, по сравнению с группой пациентов, пролеченных традиционной комплексной методикой с местным лечением ран.
Использование НИЛТ в комплексном лечении гнойных ран ведет к более быстрому переходу тканей ран пациентов СДС из воспалительной фазы в пролиферативную – раневой дефект не останавливается в фазе воспаления на длительное время, снижается риск развития дальнейших гнойно-некротических осложнений.
Применение НИЛТ в лечении гнойно-некротических ран нижних конечностей у больных сахарным диабетом благотворно влияет на количественные характеристики и клеточный состав каждой фазы регенераторного процесса: в фазу воспалительных изменений активирует процесс миграции лейкоцитов, увеличивает число макрофагов, лимфоцитов; в пролиферативной фазе способствует появлению активных фибробластов, улучшает процессы васкуляризации грануляционной ткани, наличие которой необходимо для своевременного наступления фазы эпителизации.
Список литературы
1. Мараев В.В. Лазерные технологии в лечении длительно не заживающих яз в различного генеза [Текст] / В.В. Мараев, В.И. Елисеенко, М.М. Мусаев. Лазерная медицина. 2018; 22( 2): 13–18.
2. Гейниц А.В., Дуванский В.А., Гаджиев Э. Влияние импульсной магнито- и лазеротерапии на регионарную микроциркуляцию при лечении больных гнойными ранами. Ангиология и сосудистая хирургия (Приложение). М.: 2006; 82 c.
3. Митиш В.А., Пасхалова Ю.С., Ерошкин И.А., Галстян Г.Р. Гнойно-некротические поражения стопы, критическая ишемия нижних конечностей и сахарный диабет. Неотложная медицинская помощь. 2012; 1: 35–39.
4. Зайцева Е.Л., Токмакова А.Ю. Роль факторов роста и цитокинов в репаративных процессах в мягких тканях у больных сахарным диабетом. Сахарный диабет. 2014; Т. 17(1): 59–70.
5. Вертьянов В.А. Применение лазерного излучения в лечении гнойных ран. Хирургия. 1987; 7: 22–26.
6. Берченко Г.Н., Шехтер А.Б., Николаев А.В., и др. Особенности заживления гнойных ран у больных при лечении коллагеновыми препаратами (гистохимическое и электронно-микроскопическое исследование). Архив патологии. 1985; 12: 37–44.
7. Гавриленко А.В., Мусаев М.М. Лазерные методики в комплексном лечении больных трофическими язвами нижних конечностей венозной этиологии. Хирургия. Журнал им. Н.И. Пирогова. 2011; (4): 64–67.
8. Елисеенко В.И. Патологическая анатомия и патогенез лазерной раны. Лазерная медицина. 2017; 21 (4): 5–10. DOI: 10.37895/2071-8004-2017-21-4-5-10
9. Saeedi P., Petersohn I., Salpea P., et al. Global and regional diabetes prevalence estimates for 2019 and projections for 2030 and 2045: Results from the International Diabetes Federation Diabetes Atlas, 9th edition. Diabetes Res Clin. Pract. 2019; 157: 1 07843. DOI: 10.1016/j.diabres.2019.107843
Об авторах
А. Э. БагрийРоссия
Багрий Андрей Эдуардович – доктор медицинских наук, профессор, заведующий кафедрой внутренних болезней № 2
Донецк
Ю. Г. Луценко
Россия
Луценко Юрий Григорьевич – кандидат медицинских наук, доцент кафедры хирургии ФИПО
Донецк
Д. Р. Сычёва
Россия
Сычёва Дарья Романовна, ассистент кафедры патологической анатомии
Донецк
Рецензия
Для цитирования:
Багрий А.Э., Луценко Ю.Г., Сычёва Д.Р. Морфологические особенности процессов репарации ран при применении низкоинтенсивной лазерной терапии у больных синдромом диабетической стопы. Лазерная медицина. 2023;27(3):8-14. https://doi.org/10.37895/2071-8004-2023-27-3-8-14
For citation:
Bagry A.E., Lutsenko Yu.G., Sycheva D.R. Morphological features of wound repair processes under low-level laser therapy in patients with diabetic foot syndrome. Laser Medicine. 2023;27(3):8-14. (In Russ.) https://doi.org/10.37895/2071-8004-2023-27-3-8-14
JATS XML


























