Перейти к:
Инфракрасное лазерное воздействие в комбинации с приемом аминокислот с разветвленной боковой цепью стимулирует физиологическую адаптацию скелетных мышц
https://doi.org/10.37895/2071-8004-2021-25-3-40-46
Аннотация
Лазерное воздействие стимулирует пролиферацию клеток и восстановление тканей. Аминокислоты с разветвленной боковой цепью (BCAA) широко применяются в спортивной медицине как стимулятор анаболических процессов. Однако отсутствуют данные о влиянии комбинированного применения лазера и BCAA на морфометрические характеристики мышц при физической нагрузке в тренировочном процессе.
Цель: изучение влияния инфракрасного лазерного воздействия в комбинации с приемом аминокислот на миосателлитоциты и миоциты скелетной мышцы при тренировках плаванием.
Материалы и методы. Эксперимент проведен на 30 крысах Вистар: 1-я группа – интактные; 2-я – динамический контроль (тренировки принудительным плаванием); 3-я группа – тренировки и BCAA; 4-я группа – тренировки и лазерное воздействие на мышцы бедра (970 нм, 1 Вт, 60 с); 5-я группа – тренировки, воздействие лазера в комбинации с ВСАА. Тренировки осуществлялись трижды в неделю, 6 недель, лазерное воздействие проводилось после каждой тренировки. Образцы двуглавой мышцы бедра фиксировали формалином, готовили гистологические срезы, окрашенные гематоксилином-эозином. Проводился морфометрический анализ цифрового изображения объектов со статистической обработкой методом Манна – Уитни.
Результаты. Применение лазерного воздействия комбинированного с BCAA при тренировках приводило к увеличению площади ядер и количества миосателлитов и миоцитов, увеличению поперечного сечения мышечных волокон, более выраженным по сравнению с изолированным лазерным облучением мышцы или приемом ВСАА.
Заключение. Инфракрасное лазерное воздействие в комбинации с приемом аминокислот с разветвленной боковой цепью эффективно стимулирует регенерацию путем гиперплазии и гипертрофии скелетной мышечной ткани, что обеспечивает физиологическую адаптацию при тренировочном процессе.
Для цитирования:
Галлямутдинов Р.В., Головнева Е.С., Ревель-Муроз Ж.А., Еловских И.В. Инфракрасное лазерное воздействие в комбинации с приемом аминокислот с разветвленной боковой цепью стимулирует физиологическую адаптацию скелетных мышц. Лазерная медицина. 2021;25(3):40-46. https://doi.org/10.37895/2071-8004-2021-25-3-40-46
For citation:
Gallyamutdinov R.V., Golovneva E.S., Revel-Muroz Zh.A., Elovsky I.V. Infrared laser exposure in combination with branchedchain amino acid stimulates physiological adaptation of skeletal muscles. Laser Medicine. 2021;25(3):40-46. (In Russ.) https://doi.org/10.37895/2071-8004-2021-25-3-40-46
ВВЕДЕНИЕ
Физическая нагрузка оказывает многогранное влияние на организм животных и человека: происходит перестройка работы всех важнейших органов и систем, сдвиги в нервной и эндокринной регуляции, изменения состава крови и других биологических жидкостей. Мышцы отвечают на адекватную тренировочную физическую нагрузку адаптацией биохимических процессов, энергетического обмена и гипертрофией [1–4]. Однако при несоблюдении ряда требований к частоте, интенсивности физической нагрузки, технике движений, процесс тренировок может сопровождаться дезадаптацией различной степени тяжести, что ведет к ухудшению физиологического состояния спортсмена, спортивным травмам и потере трудоспособности [5–9].
Повышение эффективности и безопасности тренировочного процесса достигается использованием различных фармакологических средств, физиотерапевтических методик и спортивного питания. Лазерное воздействие хорошо зарекомендовало себя как способ повысить пролиферацию и неоангиогенез в тканях, что создает возможность восстановить имевшиеся поврежденные участки и оптимизировать функции сохранившихся структур [10–13]. Эффективность применения лазеров для реабилитации спортсменов при интенсивном тренировочном процессе также связывают с усилением микроциркуляции и нормализации кровоснабжения мышц, что играет роль в развитии гипертрофии [14][15], но влияние лазерного излучения на пролиферативный потенциал мышечных клеток при тренировках с приемом аминокислот с разветвленной цепью (BCAA) не изучался.
Спортивное питание сочетает пищевой рацион, соответствующий потребностям организма тренирующегося, и прием особых пищевых добавок, необходимых для более быстрого и полноценного восстановления организма после физической нагрузки. Аминокислоты с разветвленной цепью (BCAA) в виде пищевой добавки представляют собой смесь трех незаменимых аминокислот: валин, лейцин, изолейцин и являются эффективным средством стимуляции процессов восстановления мышечной ткани, синтеза белков, гормонов, цитокинов, характеризуясь высокой скоростью усваивания организмом, при минимальных затратах на пищеварение [16][17]. Однако эффективность этой добавки изучалась преимущественно при силовых тренировках, а проведенные исследования касались влияния на процессы гипертрофии мышц [17][18].
В доступной литературе отсутствуют работы, отражающие комбинированное влияние лазерного воздействия на мышцы и приема BCAA на мышечную ткань при тренировках, хотя можно предполагать, что объединение эффектов этих воздействий существенно улучшит адаптацию мышц и организма в целом к физической нагрузке.
Целью исследования являлось изучение влияния инфракрасного лазерного воздействия в комбинации с приемом аминокислот с разветвленной боковой цепью на миосателлитоциты и миоциты скелетной мышечной ткани при тренировках принудительным плаванием.
МАТЕРИАЛ И МЕТОДЫ
Исследование выполнялось на 30 крысах-самцах серии Вистар в возрасте 5–7 месяцев с массой от 270 до 320 г. Содержание и обращение с животными в эксперименте соответствовали требованиям приказа Минздрава РФ № 199Н от 01.04.2016 «Об утверждении правил надлежащей лабораторной практики». Животные были разделены на пять групп по 6 особей: 1-я группа – интактный контроль, 2-я группа – динамический контроль (тренировки принудительным плаванием), 3-я группа – тренировки и прием BCAA, 4-я группа – тренировки и лазерное инфракрасное воздействие на мышцы бедра (970 нм, 1 Вт, 60 с), 5-я группа – тренировки и воздействие лазера комбинированное с приемом ВСАА.
Тренировка принудительным плаванием воспроизводилась погружением животных в емкость с водой (диаметр – 60 см, высота – 85 см, емкость – 200 л). Глубина от поверхности воды до дна, необходимая для свободного движения животного и исключающая опору конечностей, составляла не менее 55 см. Температура воды, предотвращавшая переохлаждение животных во время тренировки, поддерживалась на уровне 30 ± 1 °С. Эксперимент длился 42 дня (6 недель), тренировки проводили 3 раза в неделю, с увеличением времени плавания каждую неделю на 5 минут. В первую неделю время плавания составляло 30 минут, на последней неделе время плавания составляло 55 минут.
Пищевую добавку BCAA («Fitness Formula», Россия) животные получали вместе с питьевой водой. На поилку объемом 500 мл добавляли 2 г смеси (содержание на 1 г: L-лейцин – 0,46 г, L-валин и L-изолейцин – по 0,22 г). В день каждое животное потребляло 27 ± 1,02 мл жидкости, что в пересчете на BCAA эквивалентно 0,049 г L-лейцина и по 0,024 г L-валина и L-изолейцина. Питьевую смесь ежедневно заменяли на свежую.
Лазерное воздействие проводилось после каждой тренировки. Фотомодуляцию осуществляли лазерным аппаратом «ИРЭ Полюс» (Россия) с длиной волны 970 нм, мощностью 1,0 Вт, в непрерывном режиме излучения. Обработку таргетных поверхностей задних конечностей проводили с расстояния 5,0 мм, сканирующими движениями в течение 1 минуты. В области бедра облучали зоны двуглавой мышцы и полусухожильной мышцы.
Животных выводили из опыта на 42-е сутки путем дислокации спинного мозга под эфирным ингаляционным наркозом. Для оценки морфофункционального состояния скелетной мышечной ткани препараты двуглавой мышцы бедра фиксировали 10%-ным нейтральным забуференным формалином. После стандартной гистологической проводки и приготовления парафиновых блоков срезы окрашивались гематоксилин-эозином.
Гистологические препараты анализировали с помощью микроскопа Leica DMRXA (Германия), оснащенного цифровой видеокамерой Leica DFC 290 (Германия), сопряженной с программой анализа изображений ImageScope М (Россия). Получившиеся изображения микропрепаратов в формате графических файлов *.tiff в цветовом пространстве RGB использовали в качестве объектов для морфометрических исследований.
Количество миосателлитоцитов и миоцитов рассчитывалось на увеличении 400 (об. ×40; ок. ×10), площадь ядер миосателлитоцитов и миоцитов – с использованием функции «ручное выделение» на увеличении 1000 с использованием масляной иммерсии.
Статистическая обработка данных проводилась с помощью лицензионного пакета прикладных программ Excel 2020 и PAST версии 4.03. При обработке полученных данных использовались методы вариационной статистики. Для оценки достоверности различий между группами использовали непараметрический метод Манна – Уитни. Данные представлены в виде среднего арифметического значения и его ошибки (M ± m). Статистически значимыми считали различия при р ≤ 0,05.
РЕЗУЛЬТАТЫ
После 42-дневного тренировочного цикла принудительного плавания (2-я группа) в двуглавой мышце бедра животных происходило достоверное увеличение площади ядер миоцитов, снижалось количество миоцитов на единицу площади препарата и повышалась толщина мышечных волокон (табл. 1, рис. 1). Количество и размеры ядер миосателлитов при этом не отличались от группы интактных животных.
Таблица 1
Морфометрические показатели клеток и размеров скелетного мышечного волокна m. biceps femoris в исследуемых группах
Table 1
Morphometric parameters of cells and dimensions of skeletal muscle fiber in the m. biceps femoris in study groups
|
Показатели Indicators |
Интактные крысы Intact rats (Group 1) n = 6 |
Тренировка плаванием Swimming training |
|||
|
Динамический контроль n = 6 |
Аминокислоты (3-я группа) Aminoacids (Group 3) n = 6 |
Лазерное воздействие (4-я группа) Laser irradiation (Group 4) n = 6 |
Лазерное воздействие и аминокислоты (5-я группа) Laser irradiation and aminoacids (Group 5) n = 6 |
||
|
Относительное увеличение массы животных в процессе эксперимента, % Relative increase in animal body mass during the experiment), % |
0,27 ± 0,03 |
1,24 ± 0,24# |
2,48 ± 0,42#* |
1,31 ± 0,22# |
2,12 ± 0,26#*& |
|
Площадь ядер миосателлитов, мкм2 Area of myosatellite nuclei, μm2 |
30,66 ± 0,61 |
31,01 ± 0,94 |
33,67 ± 0,58#* |
34,08 ± 0,65#* |
38,31 ± 1,71#*^& |
|
Количество миосателлитов, n/мм2 Number of myosatellites, n/mm2 |
137,85 ± 45,29 |
151,29 ± 29,79 |
275,68 ± 28,63#* |
294,42 ± 8,34#* |
400,51 ± 20,26#*^& |
|
Площадь ядер миоцитов, мкм2 Myocyte nucleus area, μm2 |
14,65 ± 0,95 |
20,89 ± 0,82# |
20,66 ± 0,41# |
24,25 ± 1,13#* |
25,53 ± 1,78#*^ |
|
Количество миоцитов, n/мм2 Number of myocytes, n/mm2 |
1058,41 ± 46,48 |
877,24 ± 36,95# |
1220,44 ± 25,0#* |
1101,32 ± 32,18* |
1251,6 ± 76,29#*& |
|
Толщина волокна, мкм Fiber thickness, μm |
26,05 ± 1,39 |
31,11 ± 0,72# |
36,63 ± 0,71#* |
35,49 ± 0,71#*^ |
40,44 ± 1,91#* |
|
Площадь поперечного сечения волокна, мкм2 Fiber cross-sectional area, μm2 |
1450 ± 58,58 |
1514,29 ± 41,69 |
2242,16 ± 41,87#* |
2065,39 ± 34,98#* |
2217 ± 97,63#* |
Note: # – p < 0.05 when comparing with the group of intact animals; * – p < 0.05 when comparing with dynamic control group; ^ – р < 0.05 when comparing Group 3 with of Group 5; & – р < 0.05 when comparing Group 4 with Group 5.
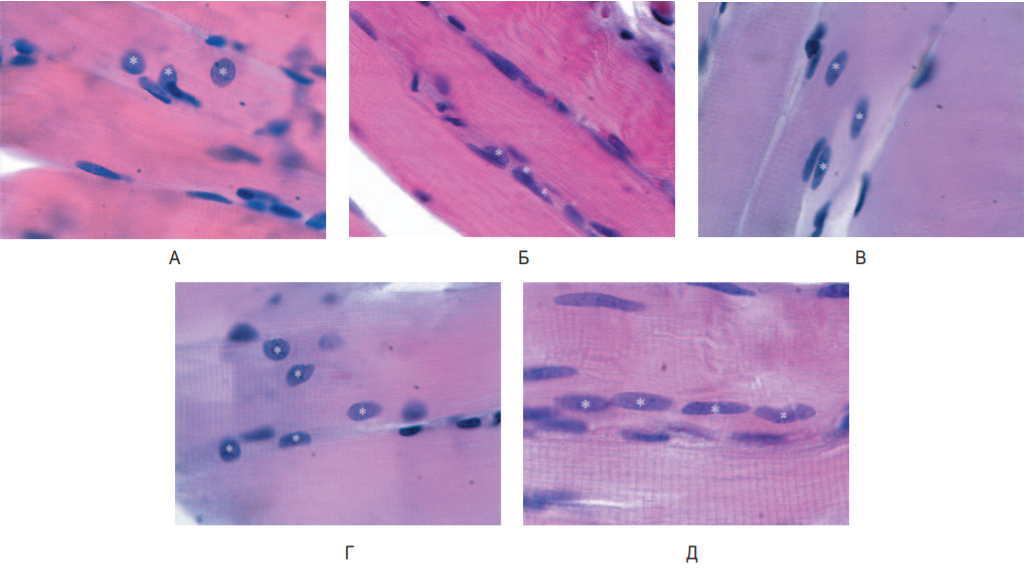
Рис. 1. Морфологическая картина m. biceps femoris в исследуемых группах. Миосателлитоциты (*) и собственные ядра мышечного волокна: А – 1-я группа, Б – 2-я группа, В – 3-я группа, Г – 4-я группа, Д – 5-я группа. Окраска – гематоксилин-эозин, увеличение – 1000, масляная иммерсия
Fig. 1. Morphological picture m. biceps femoris in study groups. Myosatellitocytes (*) and intrinsic nuclei of muscle fiber: А – Group 1, Б – Group 2, В – Group 3, Г – Group 4, Д – Group 5. Staining – hematoxylin-eosin. Magnification – 1000, oil immersion
В группе животных, получавших на фоне тренировок плаванием дополнительные нутриенты в виде BCAA (3-я группа), по сравнению группами интактного и динамического контроля, увеличивались показатели площади ядер и на 60–70 % возрастало количество миосателлитов, количество миоцитов повышалось на 20 % при одновременном увеличении размеров ядра этих клеток, на 50 % возрастала площадь поперечного сечения мышечных волокон и их толщина. Прирост массы животных в два раза превышал показатели группы динамического контроля.
Воздействие лазерного излучения на мышцы бедра после регулярных тренировок принудительным плаванием (4-я группа) привело к увеличению площади ядер зрелых и сателлитных мышечных клеток, росту количества этих клеточных элементов. У подопытных крыс 4-й группы площадь поперечного сечения мышечных волокон увеличилась в среднем на 35 %, толщина волокон возросла на 15 % по сравнению с динамическим контролем. Достоверных отличий по приросту массы животных этой группы не обнаруживалось.
В группе крыс, получавших комбинированное воздействие лазера и ВСАА, происходило наиболее выраженное увеличение всех исследуемых показателей мышечного волокна по сравнению с другими экспериментальными группами. У животных этой группы на 20–25 % увеличилась площадь ядер миосателлитов, их количество выросло в 2,6 раза, площадь ядер миоцитов увеличилась на 20 %, количество миоцитов – на 40 %, площадь поперечного сечения волокна увеличилась в 1,5 раза, толщина волокна увеличилась на 30 % по сравнению с динамическим контролем. По сравнению с группой динамического контроля и изолированного лазерного воздействия на 60–70 % увеличился прирост массы животных.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Паттерн двигательной активности крыс во время принудительного плавания характеризуется значительной нагрузкой на мышцы задних конечностей и, в частности, на двуглавую мышцу бедра. Данный способ моделирования физической нагрузки у животных отличается высокими общими энергозатратами, развитием утомления и реализуется при максимальном напряжении систем адаптации организма животного. Эти особенности модели нашли отражение в изменении исследуемых нами показателей. С одной стороны, в группе динамического контроля наблюдалось увеличение площади ядер миоцитов при увеличении толщины мышечных волокон, что характеризует явления гипертрофии. Однако наряду с адаптивными изменениями было зафиксировано снижение количества миоцитов на единицу площади препарата, причем в некоторых препаратах мышц визуализировалась картина глыбчатого распада, что указывало на истощение резервов адаптации и могло быть обусловлено чрезмерной интенсивностью тренировочного процесса или же недостаточностью поступающих энергетических и пластических ресурсов. Полученные в нашем эксперименте результаты подтверждаются данными работ, где были показаны фрагментация и очаговый глыбчатый распад миоцитов крыс при плавательной нагрузке [1]. Регенерация скелетных мышц путем активации сателлитных клеточных элементов при регулярном принудительном плавании отсутствовала, так как исследуемые характеристики миосателлитов не отличались от показателей интактной группы животных. Наблюдаемая морфологическая картина в целом характеризовала незавершенный процесс адаптации мышечной ткани к физической нагрузке.
Иная картина наблюдалась в группе животных, принимавших BCAA. Данные аминокислоты являются наиболее важными для обмена веществ и составляют 35 % от общего аминокислотного состава мышечной ткани [17][19]. Лейцин активно участвует в поддержании положительного азотистого баланса при интенсивных тренировках, энергетическом обеспечении физических нагрузок (до 10 %), повышает чувствительность тканей к инсулину, а также влияет на гемопоэз и приводит к повышению уровня гемоглобина. Изолейцин и валин активно участвуют в восстановлении миофибриллярного компонента, влияя на нормальное протекание биохимических процессов [16][17]. Эти данные объясняют адекватный адаптивный ответ мышечной ткани, когда дополнительные нутриенты и источники энергии позволяют сохранить имеющиеся зрелые мышечные клетки, обеспечить процессы гипертрофии и активацию процессов пролиферации комитированных клеток-предшественников. Наблюдавшийся в этой экспериментальной группе небольшой прирост массы животных являлся отражением происходящей перестройки пластического обмена на фоне добавочного поступления аминокислот. Полученные нами результаты демонстрируют влияние ВСАА на физиологическую регенерацию мышц при тренировке на выносливость, а не только при силовых тренировках, как было показано ранее.
Сочетание регулярных тренировок принудительным плаванием и лазерного воздействия также привело к регенераторным изменениям двуглавой мышцы бедра, сочетавшим явления гиперплазии и гипертрофии, так как происходила пролиферация миосателлитов и перестройка имеющихся миоцитов. Известно, что эффекты лазерного воздействия могут быть связаны как с улучшением регионарной микроциркуляции и неоангиогенезом, что позволяет удовлетворять энергетические и кислородные запросы мышечной ткани в процессе тренировки, так и с воздействием на продукцию факторов роста, вызывающих митотические изменения в покоящихся клетках, таких как миосателлиты [13][16][20][21]. Повышение содержания в мышечных тканях фактора роста сосудистого эндотелия и инсулиноподобного фактора роста связывают с успешно протекающими процессами адаптации к физическим нагрузкам [6][8].
Комбинированное применение лазерного воздействия и приема ВСАА логично привело к объединению эффектов двух воздействий. Наши результаты показали, что в этой группе животных наблюдались самые высокие показатели количества миосателлитов и размеров их ядер. Сохранение пула зрелых мышечных клеток, увеличение поперечных размеров мышечного волокна и повышение количества сателлитоцитов на фоне нарастающей продолжительности тренировки можно расценивать как показатели завершенной адаптации к принудительному плаванию. Комбинация этих воздействий как поддерживала нутриентные и энергетические потребности клеток при физической нагрузке, так и обеспечивала адекватное кровоснабжение и пролиферативный ответ скелетной мышечной ткани.
ЗАКЛЮЧЕНИЕ
Инфракрасное лазерное воздействие в комбинации с приемом аминокислот с разветвленной боковой цепью эффективно стимулирует регенерацию, приводя к гипертрофии скелетной мышечной ткани, что обеспечивает физиологическую адаптацию при тренировочном процессе.
Конфликт интересов
Авторы заявили об отсутствии конфликта интересов.
Conflict of interest
The authors declare no conflict of interest.
Соответствие нормам этики
Авторы подтверждают, что соблюдены права людей, принимавших участие в исследовании, включая получение информированного согласия в тех случаях, когда оно необходимо, и правила обращения с животными в случаях их использования в работе.
Compliance with ethical principles
The Authors confirm that respect the rights of the people participated in the study, including obtaining informed consent when it is necessary and the rules of treatment of animals when they are used in the study.
Список литературы
1. Ahtiainen J.P. Physiological and molecular adaptations to strength training. In: Concurrent Aerobic and Strength Training. Springer, Cham; 2019: 51–73. DOI: 10.1007/978-3319-75547-2_5
2. Hawley J.A., Lundby C., Cotter J.D., Burke L.M. Maximizing cellular adaptation to endurance exercise in skeletal muscle. Cell Metab. 2018; 27 (5): 962–976. DOI: 10.1016/j.cmet.2018.04.014
3. Murach K.A., Dungan C.M., Peterson C.A., McCarthy J.J. Muscle fiber splitting is a physiological response to extreme loading in animals. Exerc Sport Sci Rev. 2019; 47 (2): 108– 115. DOI: 10.1249/JES.0000000000000181
4. Murach K.A., Fry C.S., Kirby T.J., et al. Starring or supporting role? Satellite cells and skeletal muscle fiber size regulation. Physiology (Bethesda). 2018; 33 (1): 26–38. DOI: 10.1152/physiol.00019.2017
5. Галлямутдинов Р .В., Астахова Л.В., Головнева Е.С., Серышева О.Ю. Влияние лазерного инфракрасного излучения на некоторые морфофункциональные показатели регенерирующей скелетной мышцы в возрастном аспекте. Лазерная медицина. 2020; 24 (2–3): 90–94. DOI: 10.37895/2071-8004-2020-24-2-3-90-94
6. Klein D.J., McKeever K.H., Mirek E.T., Anthony T.G. Metabolomic response of equine skeletal muscle to acute fatiguing exercise and training. Front Physiol. 2020; 11: 110. DOI: 10.3389/fphys.2020.00110
7. Murach K.A., Fry C.S., Dupont-Versteegden E.E., et al. Fusion and beyond: Satellite cell contributions to loading-induced skeletal muscle adaptation. FASEB J. 2021; 35 (10): e21893. DOI: 10.1096/fj.202101096R
8. Perandini L.A., Chimin P., Lutkemeyer D.D.S., Câmara N.O.S. Chronic infl ammation in skeletal muscle impairs satellite cells function during regeneration: Can physical exercise restore the satellite cell niche? FEBS J. 2018; 285 (11): 1973–1984. DOI: 10.1111/febs.14417
9. Tsukamoto S., Shibasaki A., Naka A., et al. Lactate promotes myoblast differentiation and myotube hypertrophy via a pathway involving MyoD in vitro and enhances muscle regeneration in vivo. Int J Mol Sci. 2018; 19 (11): 3649. DOI: 10.3390/ijms19113649
10. Вильчинская Н.А., Шенкман Б.С. Сателлитные клетки скелетных мышц в условиях гравитационной разгрузки. Российский физиологический журнал им. ИМ Сеченова. 2021; 107 (6–7): 717–729. DOI: 10.31857/S0869813921060145
11. Leal Junior E.C.P., Lopes-Martins R.A., Dalan F., et al. Effect of 655-nm low-level laser therapy on exercise-induced skeletal muscle fatigue in humans. Photomed Laser Surg. 2008; 26 (5): 419–424. DOI: 10.1089/pho.2007.2160
12. Machado A.F., Micheletti J.K., Vanderlei F.M., et al. Effect of low-level laser therapy (LLLT) and light-emitting diodes (LEDT) applied during combined training on performance and post-exercise recovery: Protocol for a randomized placebo-controlled trial. Braz J Phys Ther. 2017; 21 (4): 296–304. DOI: 10.1016/j.bjpt.2017.05.010
13. Patrocinio T., Sardim A.C., Assis L., et al. Effect of low-level laser therapy (808 nm) in skeletal muscle after resistance exercise training in rats. Photomed Laser Surg. 2013; 31 (10): 492–498. DOI: 10.1089/pho.2013.3540
14. Assis L., Yamashita F., Magri A.M.P., et al. Effect of low-level laser therapy (808 nm) on skeletal muscle after endurance exercise training in rats. Braz J Phys Ther. 2015; 19 (6): 457– 465. DOI: 10.1590/bjpt-rbf.2014.0113
15. Barbosa R., Marcolino A., Souza V., et al. Effect of low-level laser therapy and strength training protocol on hand grip by dynamometry. J Lasers Med Sci. 2017; 8 (3): 112–117. DOI: 10.15171/jlms.2017.20
16. Fedewa M.V., Spencer S.O., Williams T.D., et al. Effect of branched-chain amino acid supplementation on muscle soreness following exercise: A meta-analysis. Int J Vitam Nutr Res. 2019; 89 (5–6):348–356. DOI: 10.1024/0300-9831/a000543
17. Fouré A., Bendahan D. Is branched-chain amino acids supplementation an efficient nutritional strategy to alleviate skeletal muscle damage? A systematic review. Nutrients. 2017; 9 (10): 1047. DOI: 10.3390/nu9101047
18. Shamim B., Hawley J.A., Camera D.M. Protein availability and satellite cell dynamics in skeletal muscle. Sports Med. 2018; 48 (6): 1329–1343. DOI: 10.1007/s40279-018-0883-7
19. Xu M., Kitaura Y., Ishikawa T., et al. Endurance performance and energy metabolism during exercise in mice with a muscle-specific defect in the control of branched-chain amino acid catabolism. PloS One. 2017; 12 (7): e0180989. DOI: 10.1371/journal.pone.0180989
20. Baroni B.M., Rodrigues R., Freire B.B., et al. Effect of lowlevel laser therapy on muscle adaptation to knee extensor eccentric training. Eur J Appl Physiol. 2015; 115 (3): 639– 647. DOI: 10.1007/s00421-014-3055-y
21. Ferraresi C., de Brito Oliveira T., de Oliveira Zafalon L., et al. Effects of low level laser therapy (808 nm) on physical strength training in humans. Lasers Med Sci. 2011; 26 (3): 349–358. DOI: 10.1007/s10103-010-0855-0
Об авторах
Р. В. ГаллямутдиновРоссия
Галлямутдинов Ростислав Винерович – научный сотрудник.
Челябинск
Е. С. Головнева
Россия
Головнева Елена Станиславовна – доктор медицинских наук, доцент, заместитель директора по научно-исследовательской работе, ГБУЗ Многопрофильный ЦЛМ; профессор кафедры нормальной физиологии, Южно-Уральский ГМУ.
Челябинск
Ж. А. Ревель-Муроз
Россия
Ревель-Муроз Жан Александрович – доктор медицинских наук, директор.
Челябинск
И. В. Еловских
Россия
Еловских Инна Владиславовна – кандидат медицинских наук, доцент кафедры патологической анатомии.
Челябинск
Рецензия
Для цитирования:
Галлямутдинов Р.В., Головнева Е.С., Ревель-Муроз Ж.А., Еловских И.В. Инфракрасное лазерное воздействие в комбинации с приемом аминокислот с разветвленной боковой цепью стимулирует физиологическую адаптацию скелетных мышц. Лазерная медицина. 2021;25(3):40-46. https://doi.org/10.37895/2071-8004-2021-25-3-40-46
For citation:
Gallyamutdinov R.V., Golovneva E.S., Revel-Muroz Zh.A., Elovsky I.V. Infrared laser exposure in combination with branchedchain amino acid stimulates physiological adaptation of skeletal muscles. Laser Medicine. 2021;25(3):40-46. (In Russ.) https://doi.org/10.37895/2071-8004-2021-25-3-40-46
JATS XML


























