Перейти к:
Фотодинамическая терапия при перипротезной инфекции суставов
https://doi.org/10.37895/2071-8004-2021-25-1-9-15
Аннотация
Цель: улучшить результаты комплексного хирургического лечения больных с глубокой перипротезной инфекцией (ППИ) путем разработки и совершенствования оперативных методов с использованием спейсеров и лазерных технологий.
Материалы и методы. Было проведено обследование и лечение 35 больных с нагноением после эндопротезирования крупных суставов. У 9 (25,7 %) больных ППИ развилась в сроки от 3 до 12 месяцев после первичного эндопротезирования. В период от 1 до 2 лет после оперативного вмешательства перипротезное инфицирование развилось у 20 (57,1 %) пациентов. В сроки от 2 до 3 лет в 4 (11,4 %) случаях возникло нагноение в области эндопротезирования, а у 2 (5,7 %) человек ППИ развилась в сроки от 3 до 3,5 лет после установки протеза. Больные были в возрасте 47–70 лет. Основную группу составили 20 человек, контрольную – 15. Больным основной группы, после удаления элементов эндопротеза и девитализированных тканей, проводили фотодинамическую терапию.
Результаты. У больных основной группы было гладкое течение послеоперационного периода – снижение болевого синдрома, быстрое разрешение воспалительного процесса в области операции, заживление ран первичным натяжением.
Заключение. Использование разработанного нами нового метода интраоперационной фотодинамической терапии способствует быстрому купированию гнойно-воспалительного процесса и заживлению послеоперационной раны первичным натяжением.
Ключевые слова
Для цитирования:
Гусейнов А.И., Баранов А.В., Раджабов А.А., Дербенев В.А., Карандашов В.И., Александрова Н.П. Фотодинамическая терапия при перипротезной инфекции суставов. Лазерная медицина. 2021;25(1):9-15. https://doi.org/10.37895/2071-8004-2021-25-1-9-15
For citation:
Guseynov A.I., Baranov А.V., Radzhabov A.A., Derbenev V.A., Karandashov V.I., Alexandrova N.P. Photodynamic therapy for periprosthetic joint infection. Laser Medicine. 2021;25(1):9-15. (In Russ.) https://doi.org/10.37895/2071-8004-2021-25-1-9-15
ВВЕДЕНИЕ
Увеличение числа больных с патологией суставов является актуальной проблемой клинической медицины. Эндопротезирование стало стандартом лечения больных с терминальной стадией остеоартроза. К его несомненным положительным факторам следует отнести быстрое восстановление безболезненных движений в суставе, а также опороспособности конечности в короткий реабилитационный период. Вместе с тем использование различных технологий установки эндопротезов сопряжено со значительным количеством послеоперационных осложнений [1][2].
Показатели инфицирования после первичной замены сустава составляют 0,2–3 %, а при повторных вмешательствах ревизионного характера риск инфицирования возрастает до 33 %. При этом, по данным зарубежной литературы, отмечается развитие рецидива воспалительного процесса до 82 %, со значительной степенью вероятности генерализации гнойного процесса (58 %) и летального исхода [3][4][5].
Перипротезная инфекция (ППИ) – острая или хроническая инфекция области хирургического вмешательства, развившаяся после имплантации эндопротеза сустава, представляет собой частный случай имплантат-ассоциированной инфекции [6]. Несмотря на относительно невысокую частоту развития ППИ после первичного эндопротезирования (0,3–3 %), в случае ревизионного характера операции риск развития инфекции возрастает в несколько раз, достигая 5,9–13,6 %, а частота рецидивов при лечении уже существующей ППИ составляет 23,2–31,5 % [1][4][7][8][9].
Данные литературы свидетельствуют о необходимости поиска новых способов хирургической санации, направленных не только на купирование воспалительного процесса, но и на создание условий для последующей реимплантации суставов [5][7][10][11].
В лечении пациентов с ППИ тазобедренного и коленного суставов применяется комплексный подход, направленный на купирование воспалительного процесса, при сохранении анатомо-функциональных свойств сустава, и восстановление опороспособности конечности в возможно более короткие сроки. Больше всего вышеуказанным условиям соответствуют операции двухэтапного ревизионного эндопротезирования с применением артикулирующих спейсеров, импрегнированных антимикробными химиопрепаратами. Первым этапом выполняют хирургическую обработку и дебридмент раны, с сохранением эндопротеза, устанавливают цементный спейсер с антибиотиком. Вторым этапом через несколько месяцев выполняют повторную хирургическую обработку раны с удалением спейсера, заменяют модульные компоненты эндопротеза и ушивают рану.
Это относительно новый метод хирургической лечения и реабилитации пациентов с глубокой перипротезной инфекцией, эффективность которого доходит до 85 % [12].
В связи с увеличением устойчивых штаммов бактерий к антибиотикам в настоящее время актуальными стали способы преодоления резистентности раневой микрофлоры к химиотерапии. Одной из новых и перспективных технологий является фотодинамическая терапия (ФДТ), которая эффективно ускоряет деконтаминацию раневой поверхности. Преимущество фотодинамической терапии состоит в том, что гибель микрофлоры достигается за очень короткий промежуток времени, практически полностью отсутствует устойчивость бактерий к фотодинамической терапии, при этом полностью исключается какое-либо повреждение здоровых тканей. Этот метод является полезной альтернативой применения антибиотиков и антисептиков, оказывает противовоспалительное и стимулирующее репаративные процессы действие [5][12].
Многочисленными исследованиями показано, что внутривенное лазерное облучение крови оказывает полифакторное положительное действие на функцию органов и систем, важнейшими из которых являются: активация микроциркуляции крови; активация кислородтранспортной функции крови и тканевого дыхания; нормализация реологии крови; восстановление равновесия свертывающей и противосвертывающей систем; противовоспалительное, иммуномодулирующее, стимулирующее репаративные процессы и анальгезирующее действие; повышение уровня трофического обеспечения тканей [2].
Цель исследования: улучшить результаты комплексного хирургического лечения больных с ППИ путем разработки и совершенствования оперативных методов с использованием спейсеров и лазерных технологий.
МАТЕРИАЛЫ И МЕТОДЫ
Было проведено обследование и лечение 35 больных с нагноением после эндопротезирования крупных суставов (локтевой, тазобедренный и коленный). У 9 (25,7 %) больных ППИ развилась в сроки от 3 до 12 месяцев после первичного эндопротезирования. В период от 1 до 2 лет после оперативного вмешательства перипротезное инфицирование развилось у 20 (57,1 %) пациентов. В сроки от 2 до 3 лет в 4 (11,4 %) случаях возникло нагноение в области эндопротезирования, а у 2 (5,7 %) человек ППИ развилась в сроки от 3 до 3,5 лет после установки протеза.
По локализации гнойного процесса поражение в области эндопротеза тазобедренного сустава было у 19 (54,3 %) пациентов, коленного сустава – у 14 (40 %) больных и у 2 (5,7 %) человек – в области локтевого сустава.
Возраст больных был от 47 до 70 лет, средний возраст пациентов составлял 59 ± 4,6 года. У большинства из них была сопутствующая патология: сахарный диабет, гипертоническая болезнь, ХИБС, ХОБЛ, пиелонефрит, ожирение 3–4-й степени, хроническая венозная и артериальная недостаточность, лечение которых осуществляли узкие специалисты.
Клиническое обследование больных включало, в числе прочего, микробиологическое исследование отделяемого из гнойного очага в предоперационном периоде. Использовали общепринятые методы посева, выделения и идентификации микроорганизмов. Чувствительность к антибиотикам определяли дискодиффузионным методом.
Нестабильность эндопротеза как инородного тела с наличием гнойных свищей и многомесячного существования инфекции в перипротезных тканях являлась показанием к удалению эндопротеза и санации гнойного очага.
Противопоказаниями к операции были наличие декомпенсированной сердечно-сосудистой или дыхательной недостаточности, ОНМК, деменция, тяжелое состояние больного за счет сопутствующих заболеваний.
В зависимости от способа лечения больных разделили на две группы: 20 пациентов составили основную группу и 15 – контрольную. Больные обеих групп были сопоставимы по возрасту, полу, тяжести течения гнойного процесса, наличию сопутствующей патологии. Больным основной группы, после удаления элементов эндопротеза и девитализированных тканей, проводили ФДТ. Операцию заканчивали установкой спейсера, импрегнированного двумя антибиотиками широкого спектра действия, согласно чувствительности к антибиотикам у выделенной перед операцией микрофлоры. Больным контрольной группы после удаления эндопротеза и девитализированных тканей устанавливали спейсер – приспособление на основе биосовместимого материала (полиметилметакрилат) с включением в его состав двух антибиотиков широкого спектра действия, согласно антибиотикограмме выделенной микрофлоры.
Предложенный нами способ лечения с применением лазерных технологий (получен патент на изобретение: № 2712806 от 31.01.2020 г.) заключается в следующем. Предварительно, по данным КТ и 3D-моделирования изготавливали гипсовую модель сустава пациента со всеми дефектами. С помощь гипсовой модели отливали силиконовую форму протеза. За 30 минут до оперативного вмешательства проводили предоперационную инфузионную терапию, включающую в себя помимо поляризационной смеси и коллоидных растворов внутривенное введение фотосенсибилизатора «Фотодитазин» (производное хлорина Е-6, производство фирмы «Вета Гранд», Россия) в дозе 0,8 мг/кг на 100 мл физиологического раствора натрия хлорида. Во время оперативного вмешательства вначале повторно осуществляли забор не менее 4–6 образцов из глубины тканей для определения состава микрофлоры и чувствительности к антибиотикам, затем удаляли эндопротез, иссекали нежизнеспособные и пропитанные гноем ткани до видимо здоровых. Следующим этапом проводили световое воздействие с экспозицией 1 мин на раневую поверхность излучением лазерного аппарата «Аткус-2» с рассеивающей насадкой К1, с длиной волны излучения 661 ± 0,3 нм. Плотность энергии излучения на поверхности раны составляла 30–40 Дж/см2. Затем в предварительно изготовленную стерильную силиконовую форму отливали артикулирующий спейсер из костного цемента, в массе сухого вещества от 120 до 160 г смешанного с двумя порошкообразными антибиотиками (чаще гентамицин и ванкомицин), из расчета 1 г каждого антибиотика на 40 г костного цемента. Полученный артикулирующий спейсер устанавливали в очищенное ложе эндопротеза. Через контрапертуры проводили дренажную трубку, рану ушивали наглухо. Следует отметить, что проведение ФДТ не усложняло и существенно не увеличивало продолжительность оперативного вмешательства.
Послеоперационное лечение включало инфузионно-дезинтоксикационную терапию, антибактериальную терапию, перевязки послеоперационной раны с промыванием дренажной трубки. По показаниям вводились анальгетики, проводилось лечение сопутствующих заболеваний, клинико-лабораторные и инструментальные исследования в динамике, лечебную физкультуру. В контрольной группе антибиотикотерапию проводили от 4 до 12 недель, в основной группе – до 3 недель с учетом результатов посева во время операции (в стационаре – парентерально, амбулаторно – перорально). Больным основной и контрольной групп проводили ВЛОК с помощью аппарата «Матрикс-ВЛОК» (НИЦ «Матрикс», Россия), использовали длину волны 450 нм, мощность излучения на торце световода – 1 мВт, экспозиция – 20 мин, курс составлял 10 сеансов. Пациентам рекомендовали ходьбу с костылями с дозированной нагрузкой на оперированную ногу. Швы снимали на 10–12-е сутки.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Микробный пейзаж гнойных очагов у больных был разнообразным, включал как грамположительные, так и грамотрицательные микроорганизмы в монокультуре или в ассоциации (табл. 1).
Таблица 1
Частота выделения возбудителей из раны
Table 1
Frequency of excretion of pathogen from the wound
Тип возбудителя Pathogen type | Монокультура Pure culture | Ассоциация | ||
абс. absolute number | % | абс. absolute number | % | |
Staphylococcus aureus | 8 | 22,8 | 1 | 2,9 |
Escherichia coli | 11 | 31,4 | 7 | 23 |
Pseudomonas aeruginosa | – | – | 3 | 7,1 |
Proteus mirabilis | 1 | 2,9 | 4 | 10,1 |
Всего Total | 20 | 57,1 | 15 | 42,9 |
При поступлении в посевах гноя из ран или свищей выделяли, в основном, грамотрицательную микрофлору (E. сoli, Рs. аeruginosa, Pr. mirabilis) в концентрации 103–109 КОЕ/г, реже выделяли St. аureus в высокой (108–109 КОЕ/г) концентрации.
Характерным являлось наличие у выделенной микрофлоры устойчивости к большинству используемых антибиотиков (табл. 2).
Таблица 2
Чувствительность выделенной микрофлоры к антибиотикам
Table 2
Antibiotic sensitivity to the isolated microflora
Антибиотик Antibiotic | Чувствительность, % Sensitivity, % |
Ванкомицин Vancomycin | 99,9 ± 0,1 |
Линезолид Linezolid | 98,1 ± 0,2 |
Меропенем Meropenem | 72,8 ± 1,8 |
Амоксиклав Amoxiclav | 60,8 ± 1,8 |
Ципрофлоксацин Ciprofloxacin | 50,5 ± 2,2 |
Гентамицин Gentamicin | 50,2 ± 2,2 |
Амикацин Amikacin | 45,8 ± 2,2 |
Цефазолин Cefazolin | 51,5 ± 2,8 |
Линкомицин Lincomycin | 26,5 ± 2,2 |
Доксициклин Doxycycline | 17,6 ± 1,2 |
Ампициллин Ampicillin | 10,8 ± 1,2 |
У больных основной группы было гладкое течение послеоперационного периода – раннее купирование болевого синдрома, быстрое разрешение воспалительного процесса в области хирургического вмешательства, заживление ран первичным натяжением. В контрольной группе у 2 (13,3 %) пациентов отмечено нагноение послеоперационной раны на 5-е и 6-е сутки. Продолжительность стационарного лечения у больных контрольной группы составила 14 ± 0,8 дня, а в основной группе – 12,2 ± 0,4 дня (р < 0,05). В отдаленном периоде (от 3 месяцев до 2 лет) у пациентов основной группы обострений воспалительного процесса в области операции не отмечено. В контрольной группе у 2 (13,3 %) больных в течение 3 месяцев после выписки из стационара развился абсцесс в области операции, потребовавший хирургической обработки гнойного очага.
У больных обеих групп, благодаря установке цементного спейсера, сохранилась опороспособность. В сроки от 6 до 11 месяцев после установки антибиотик-интегрированного спейсера 6 пациентам основной группы выполнено ревизионное эндопротезирование.
Таким образом, интраоперационное применение ФДТ с установкой антибиотик-импрегнированного спейсера в лечении ППИ позволило снизить количество послеоперационных осложнений, сократить сроки стационарного лечения, уменьшить медикаментозную нагрузку на больного и получить хорошие функциональные результаты на протяжении срока наблюдения до 2 лет.
Для иллюстрации применения способа лечения приводим описание двух клинических случаев.
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ 1
Больная Ф., 70 лет, поступила в клинику с диагнозом: глубокая перипротезная инфекция левого тазобедренного сустава, остеомиелит бедренной кости, свищевая форма с образованием свища с обильным гнойным отделяемым (рис. 1).
В анамнезе: 10 месяцев назад было произведено эндопротезирование тазобедренного сустава. Через 2 недели после операции возникло нагноение в области операции.
Многократно лечилась в стационарах с временным улучшением, но рана полностью не заживала. В посеве из гноя выделена ассоциация микроорганизмов: St. aureus, чувствительный к меропенему, имипенему, рифампицину, амоксиклаву и амикацину, а также Proteus mirabilis, чувствительный к меропенему, имипенему, рифампицину, тобрамицину. При рентгенографии тазобедренного сустава – несостоятельность эндопротеза с дефектами вертлужной впадины. Больной выполнена операция: хирургическая обработка гнойного очага с удалением инфицированного эндопротеза и девитализированных тканей, проведение ФДТ по вышеизложенной методике и установка артикулирующего цементного спейсера, импрегнированного двумя антибиотиками широкого спектра действия.
В результате лечения достигнуто купирование гнойно-воспалительного процесса, рана зажила первичным натяжением, больная выписана через 10 дней после оперативного вмешательства. Через 6 месяцев больной произвели операцию – реэндопротезирование, в ходе которой спейсер заменили на постоянный эндопротез. Через 6 месяцев больная жалоб не предъявляет, ходит с палочкой.
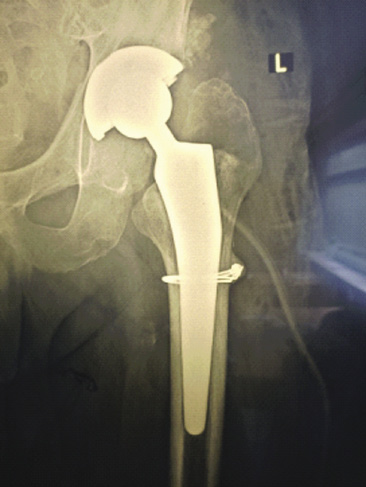
Рис. 1. Больная Ф., рентгенограмма левого тазобедренного сустава до лечения
Fig. 1. Patient F., X-ray image of the left hip joint before treatment
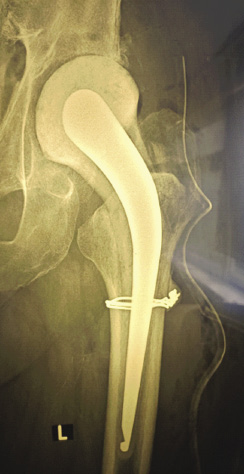
Рис. 2. Больная Ф., рентгенограмма после установки спейсера
Fig. 2. Patient F., X-ray image after the spacer installation
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ 2
Больная Г., 52 года, поступила в клинику с диагнозом: перелом плечевой кости с дислокацией элементов эндопротеза в мягкие ткани; глубокая перипротезная инфекция, остеомиелит локтевой и плечевой костей, свищевая форма (рис. 3).
Больной выполнена операция: хирургическая обработка гнойного очага с удалением инфицированного эндопротеза, проведение лазерной ФДТ по вышеизложенной методике и установка артикулирующего цементного спейсера, импрегнированного двумя антибиотиками широкого спектра действия (рис. 4, 5). В результате достигнуто полное купирование гнойно-воспалительного процесса, через 10 дней швы сняты, рана зажила первичным натяжением. Больная выписана с рекомендацией выполнить через 6 месяцев реэндопротезирование.
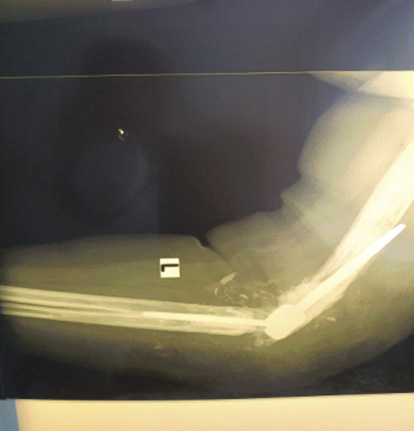
Рис. 3. Больная Г., рентгенограмма сустава при поступлении
Fig. 3. Patient G., X-ray image of the joint on admission

Рис. 4. 3D-элементы антибактериального спейсера
Fig. 4. 3D-elements of antibacterial spacer

Рис. 5. Больная Г., рентгенограмма после установки антибактериального спейсера
Fig. 5. Patient G., X-ray image after the installation of the antibacterial spacer
ЗАКЛЮЧЕНИЕ
Применение разработанного нами нового комплексного метода лечения больных перипротезной инфекцией после эндопротезирования сустава с использованием интраоперационной ФДТ способствует быстрому купированию гнойно-воспалительного процесса, позволяет снизить количество послеоперационных осложнений, сократить сроки стационарного лечения, получить хорошие функциональные результаты и в кратчайшие сроки провести следующий этап – реэндопротезирование.
На предложенный нами метод получен патент РФ № 2712806 от 31.01.2020 г. «Способ лечения больных перипротезной инфекцией после эндопротезирования сустава».
Список литературы
1. Артюх В .А., Божкова С.А., Кочиш А.Ю. Диагностика и лечение перипротезной инфекции тазобедренного сустава. В кн.: Руководство по хирургии тазобедренного сустава; под ред. Р.М. Тихилова, И.И. Шубнякова. 2015; 2: 208–257.
2. Толстых П.И. Теоретические и практические аспекты фотодинамической терапии ран различного генеза. Проле- гомены; под ред. П.И. Толстых, О.Э. Луцевича. М.: Альта- ир; 2012: 249.
3. Баитов В.С., Ганчуков Е.Б. Инфекционные осложнения при тотальном эндопротезировании коленного сустава. Современные проблемы науки и образования. 2017; 5.
4. Кэмпбел М.Д. Борьба с инфекцией при тотальной артропластике коленного сустава. В кн.: Ревизионное эндопротезирование коленного сустава: руководство для врачей; под ред. Д.Дж. Джакофски, Э.К. Хедли; пер. с англ. под ред. Н.В. Загородного. М.: ГЭОТАР-Медиа; 2015: 320.
5. Раджабов А.А., Дербенев В.А. и др. Антибактериальная фотодинамическая терапия гнойных ран мягких тканей. Лазерная медицина. 2017; 21 (2): 24–26.
6. Инфекция, ассоциированная с ортопедическими имплантатами: Клинические рекомендации Ассоциации травматологов-ортопедов России (АТОР). 2020: 5.
7. Белов Б.С., Макаров С.А., Бялик Е.И. Инфекция протезированного сустава: современные подходы к диагностике и лечению. Антибиотики и химиотерапия. 2015; 60 (1– 2): 47–52.
8. Bertani A., Drouin C., Demortière E., et al. A prosthetic joint infection caused by Streptococcus pneumoniae: A case report and review of the literature. Rev Chir Orthop Reparatrice Appar Mot. 2006; 92 (6): 610–614.
9. Estes C.S., Beauchamp C.P., Clarke H.D., et al. A two-stage retention debridement protocol for acute periprosthetic joint infections. Clin Orthop Relat Res. 2010; 468 (8): 2029–2038.
10. Жарова Т.А., Иванников С.В., Странадко Е.Ф. и др. Перспективы применения фотодинамической терапии и реконструктивных артроскопических технологий с использованием лазерного излучения при артрозах крупных суставов. Лазерная медицина. 2014; 18 (4): 40–41.
11. Janz V., Bartek B., Wassilew G.I., et al. Validation of synovial aspiration in girdlestone hips for detection of infection persistence in patients undergoing 2-stage revision total hip arthroplasty. J Arthroplasty. 2016; 31 (3); 684–687.
12. Шпиняк С.П, Барабаш А.П., Лясникова А.В. Применение спейсеров в лечении инфекционных осложнений тотального эндопротезирования коленного сустава. Современные проблемы науки и образования. 2015; 5.
Об авторах
А. И. ГусейновРоссия
Гусейнов Али Исрафилович – кандидат медицинских наук, заведующий отделением гнойной хирургии
Москва
А. В. Баранов
Россия
Баранов Алексей Викторович – доктор медицинских наук, директор
Москва
А. А. Раджабов
Россия
Раджабов Абдугани Абдукаюмович – доктор медицинских наук, руководитель отделения хирургической инфекции
Москва
В. А. Дербенев
Россия
Дербенев Валентин Аркадьевич – доктор медицинских наук, профессор, главный научный сотрудник отделения хирургической инфекции
Москва
В. И. Карандашов
Россия
Карандашов Владимир Иванович – доктор медицинских наук, профессор, руководитель отделения лазерных биотехнологий и клинической фармакологии
Москва
Н. П. Александрова
Россия
Александрова Наталья Павловна – доктор биологических наук, профессор, ведущий научный сотрудник отдела медицинской реабилитации
Москва
Рецензия
Для цитирования:
Гусейнов А.И., Баранов А.В., Раджабов А.А., Дербенев В.А., Карандашов В.И., Александрова Н.П. Фотодинамическая терапия при перипротезной инфекции суставов. Лазерная медицина. 2021;25(1):9-15. https://doi.org/10.37895/2071-8004-2021-25-1-9-15
For citation:
Guseynov A.I., Baranov А.V., Radzhabov A.A., Derbenev V.A., Karandashov V.I., Alexandrova N.P. Photodynamic therapy for periprosthetic joint infection. Laser Medicine. 2021;25(1):9-15. (In Russ.) https://doi.org/10.37895/2071-8004-2021-25-1-9-15
JATS XML


























